Основы формальной кинетики.
5.3.1. Реакции нулевого порядка (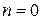 ) – это реакции, скорость которых не зависит от концентрации реагирующих веществ.
) – это реакции, скорость которых не зависит от концентрации реагирующих веществ.
Реакции нулевого порядка протекают, если:
а) концентрация исходного вещества автоматически поддерживается постоянной (например, в насыщенном растворе, находящемся в равновесии с избытком нерастворенного вещества);
б) при протекании фотохимических и каталитических реакций, скорость которых определяет количество поглощенного света и количество катализатора.
Для реакции нулевого порядка
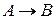
основной закон химической кинетики записывают:
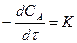 .
.
В результате интегрирования, получим:
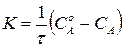 . (214)
. (214)
где 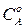 – начальная концентрация вещества
– начальная концентрация вещества 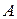 в момент времени
в момент времени 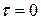 .
.
Зная константу скорости реакции, можно рассчитать концентрацию реагирующих веществ в любой момент времени:
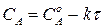 . (215)
. (215)
Для характеристики скорости реакции часто используют время полупревращения или полураспада 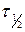 , т.е. время, в течение которого начальная концентрация исходного вещества снижается на половину
, т.е. время, в течение которого начальная концентрация исходного вещества снижается на половину 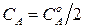 .
.
Для реакции нулевого порядка:
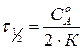 ,
, 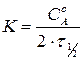 .
.
5.3.2. Реакции первого порядка (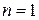 ).
).
Пусть протекает реакция первого порядка:
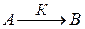 .
.
Уравнение скорости химической реакции 1 порядка имеет вид:
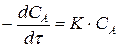 .
.
Отсюда имеем:
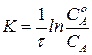 . (216)
. (216)
Из уравнения (216) можно получить уравнение для расчета концентрации вещества 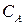 в любой момент времени:
в любой момент времени:
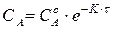 . (217)
. (217)
Получим уравнение для времени полупревращения 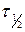 :
:
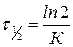 ,
, 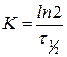 .
.
Как видно, время полупревращения реакции 1 порядка не зависит от концентрации исходного вещества и обратно пропорционально константе скорости реакции.
Константа скорости мономолекулярных реакций характеризует среднюю продолжительность жизни отдельных молекул, которая равна обратной величине константы скорости и не зависит от начальной концентрации реагирующего вещества
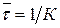 .
.
5.3.3. Реакции второго порядка (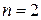 ).
).
Для необратимой реакции второго порядка:
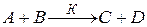 ,
,
кинетическое уравнение реакции имеет вид
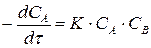 .
.
Откуда после интегрирования получим:
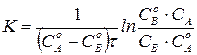 , (218)
, (218)
где 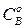 – исходная концентрация вещества
– исходная концентрация вещества 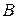 .
.
Полученное уравнение применимо для случая, когда исходные концентрации реагирующих веществ различны, т.е. 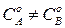 .
.
Для случая, когда 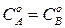 .
.
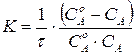 . (219)
. (219)
Текущую концентрацию вещества 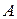 можно рассчитать по формуле:
можно рассчитать по формуле:
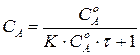 . (220)
. (220)
Время полупревращения вещества для реакции 2 порядка при 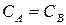 рассчитывают по уравнению:
рассчитывают по уравнению:
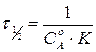 ,
, 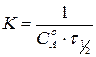 .
.
Таким образом, время полупревращения и константа скорости реакции второго порядка обратно пропорциональна начальной концентрации исходного вещества.
5.3.4. Реакции 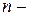 го порядка.
го порядка.
Для частного случая, когда концентрации всех реагирующих веществ одинаковы и 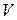 системы постоянен, кинетическое уравнение можно представить в виде:
системы постоянен, кинетическое уравнение можно представить в виде:
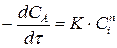 .
.
Уравнение для константы скорости запишется
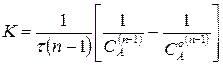 . (221)
. (221)
Время полупревращения и константа скорости реакции 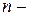 го порядка обратно пропорциональны начальной концентрации исходного вещества в степени
го порядка обратно пропорциональны начальной концентрации исходного вещества в степени 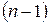 :
:

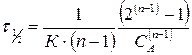 .
.

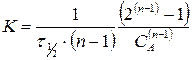 .
.
 2014-02-12
2014-02-12 11433
11433
