Для установления порядка реакции необходимо получить экспериментальные данные, описывающие изменение концентрации реагирующих веществ с течением времени, т.е. снять кинетическую кривую 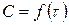 . Как правило, за скоростью реакции следят по веществу, концентрацию которого легко определить химическим или физико-химическим методом.
. Как правило, за скоростью реакции следят по веществу, концентрацию которого легко определить химическим или физико-химическим методом.
1. Метод подстановки состоит в эмпирическом подборе кинетического уравнения такого порядка, которое наилучшим образом описывает результаты эксперимента. Существует два варианта реализации метода подстановки.
1.1. Аналитический способ заключается в расчете по опытным значениям концентраций в различные моменты времени константы скорости по уравнениям для реакций различных порядков. Уравнение удовлетворительно описывает процесс, если рассчитанные по нему значения констант колеблются около какой-либо средней величины и отклонения от среднего лежат в пределах погрешности определения.
1.2. Графический способ основан на том, что зависимость концентрации от времени для реакций различных порядков в соответствующей системе координат может быть выражена прямой линией.
Так, для реакций 0-го порядка зависимость концентрации реагирующего вещества от времени имеет линейный вид (215) (рис. 34 а):
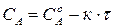 .
.

Для реакций 1-го порядка из уравнения (216) получаем прямую в системе координат 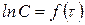 (рис. 34 б):
(рис. 34 б):
 .
.
Для реакции 2-го порядка при 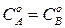 из (219) – в координатах
из (219) – в координатах 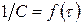 (рис. 34 в):
(рис. 34 в):
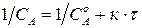 .
.
Для реакции 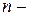 го порядка при одинаковых исходных концентрациях реагирующих веществ из (221) – в координатах
го порядка при одинаковых исходных концентрациях реагирующих веществ из (221) – в координатах 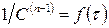 (рис. 34 г):
(рис. 34 г):
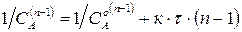 .
.
Выбирают случай, когда зависимость прямолинейная. По тангенсу угла наклона определяют значение константы скорости.
Метод подстановок точен и часто применяется на практике (не только для определения порядка реакции). Недостатком метода является его трудоемкость.
2. Метод Вант-Гоффа основан на определении абсолютной скорости реакции в начальный момент времени при двух различных исходных концентрациях реагирующего вещества (рис. 35). Тогда:
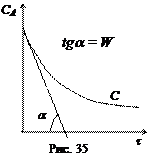
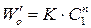 ;
; 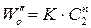 ,
,
где 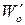 ,
, 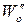 – скорость реакции при исходной концентрации реагирующего вещества
– скорость реакции при исходной концентрации реагирующего вещества 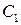 и
и 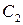 , соответственно;
, соответственно;
Логарифмируя уравнения, почленно вычитая их друг из друга и решая относительно 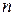 , получим:
, получим:
 .
.
Метод Вант-Гоффа прост, точен и достаточно часто применяется на практике. Он позволяет находить не только целые, но и дробные порядки реакции.
3. Графический метод. Запишем кинетическое уравнение в виде:

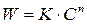 ,
,
прологарифмируем
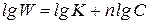 .
.
Полученное уравнение является линейным, поэтому порядок реакции 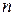 будет равен тангенсу угла наклона прямой.
будет равен тангенсу угла наклона прямой.
Недостаток метода заключается в необходимости графического определения абсолютной скорости реакции 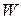 в различые моменты времени, что может привести к ошибкам.
в различые моменты времени, что может привести к ошибкам.
4. Метод изоляции или избытка концентраций (Оствальда) основан на исследовании зависимости скорости реакции от начальной концентрации какого-либо одного реагента. Для этого в опытах меняют начальную концентрацию одного реагента, а другие исходные вещества берут в большом избытке – тогда концентрации этих веществ можно принять постоянными. Порядок по первому реагенту определяют одним из вышеуказанных методов. Затем проводят аналогичные опыты с переменной начальной концентрацией другого исходного вещества в избытке остальных. Общий порядок реакции равен сумме порядков по отдельным компонентам.
Кроме того, известны методы определения порядка реакции по времени полупревращения вещества, метод Оствальда-Нойеса и др.
 2014-02-12
2014-02-12 7578
7578
