Ц е л и р а б о т ы:
1. Изучить цветные реакции на белки и аминокислоты.
2. Освоить методы идентификации отдельных аминокислот и белков.
Качественные цветные реакции на аминокислоты и белки позволяют обнаружить и идентифицировать аминокислоты и белки в биологическом материале. Цветные реакции подразделяются на универсальные и специфические. Универсальными цветными реакциями на белок являются биуретовая и нингидриновая. Специфические цветные реакции обусловлены наличием в белковой молекуле определенной аминокислоты. Характерный результат цветной реакции – окрашенный продукт. Основные цветные реакции приведены в табл. 4.
Таблица 4
Качественные реакции на аминокислоты и белки
| Реакции | Используемый реактив | Определяемый белок или аминокислота | Результат реакции |
| Биуретовая (реакция Пиотровского) | Биуретовый реактив (CuSO4 + NaOH + NaKC4H4O6) | Белки Полипептиды Олигопептиды | Комплекс сине-фиолетового цвета |
| Ксантопротеиновая реакция | Концентрированная азотная кислота (HNO3) | Циклические аминокислоты Белки, содержащие циклические аминокислоты | Лимонно-желтое окрашивание |
| Нингидриновая реакция | Нингидрин | Белки | Комплекс синего цвета (ДИДА) |
| Реакция Миллона | Реактив Миллона (HgNO3, HNO3) | Тирозин Белки, содержащие тирозин | Осадок красного цвета – ртутная соль нитропроизводного |
| Реакция Адамкевича | Глиоксиловая кислота (CH2O4) | Триптофан | Красно-фиолетовое окрашивание |
| Реакция Шульца-Распайля | Оксиметилфурфурол | Триптофан | Красно-фиолетовое окрашивание |
| Реакция Паули | Диазобензолсульфокислота | Тирозин Гистидин | Азокраситель красного цвета |
| Реакция Сакагучи | a-нафтол | Аргинин | Красное окрашивание |
| Реакция Фоля | Pb(CH3COO)2 + NaOH | Серосодержащие аминокислоты (цистин, цистеин, метионин) | Черный осадок PbS |
| Нитропруссидная реакция (реакция Мак-Карти и Салливана) | Нитропруссид Na2[Fe(CN)5NO] | Серосодержащие аминокислоты | Красное окрашивание |
| Метод Лоури | Реактив Фолина | Белки | Зеленое окрашивание |
| Реакция Ван-Слейка | HNO3 | Аминокислоты | Газообразный N2 |
| Реакция Сэнгера | 1-фтор-2-4-динитробензол | Аминокислоты N-концевые в пептиде | Отщепление N-аминокислоты |
| Реакция Эдмана | Фенилизотиоцианит (ФИТЦ) | Аминокислоты N-концевые в пептиде | Отщепление N-аминокислоты |
| Метод Акабори | Гидразин N2H2 | С-концевые аминокислоты в полипептиде | Отщепление C-аминокислоты |
| Реакция Геллера | HNO3 | Белок | Белый осадок |
Рассмотрим реакции, которые не включены в лабораторную работу. Например, для количественного определения аминокислот используется метод Ван-Слейка, основанный на взаимодействии аминокислот с азотистой кислотой с выделением N2, по объему N2 рассчитывают содержание аминокислот:
R-CH-COOH R-CH-COOH
½ + HNO3 ® ½ + N2 + H2 O
NH2 OH
Важными реакциями на аминогруппы являются реакции Сэнгера и Эдмана. Они используются для идентификации N-концевых аминокислот полипептидных цепей, для установления порядка чередования аминокислот в белке.
Рассмотрим метод Эдмана. Реагентом, взаимодействующим с белком, является фенилизотиоцианат (ФИТЦ). ФИТЦ отрывает концевую N-аминокислоту от полипептидной цепи. Укороченный полипептид снова реагирует с ФИТЦ с отделением следующей N-аминокислоты:
 R1 R2
R1 R2
 | | pH>7
| | pH>7
-N=C=S +H2N-CH- C -NH-CH … ¾¾¾®
||
O
ФИТЦ

 S H R1 R2
S H R1 R2

 || | | | pH< 7 -N¾C – N – CH – C–NH- CH
|| | | | pH< 7 -N¾C – N – CH – C–NH- CH

 | ||
| ||
 H O
H O
-
ФИТЦ-производное
S H
|| |

 N
N
 pH<7
pH<7
¾® - N- + пептид
\
|| R1
O
ФИТЦ-производное
Для установления N-концевых аминокислот в белке применяется метод Сэнгера. Реактивом в реакции Сэнгера является динитрофторбензол (ДНФБ):
 |
O2N- -F + H2N-CH-CO-NH-… ¾®
 ДФНБ NO2
ДФНБ NO2
 |
-HF 
O2N- -N¾CH-CO-NH-…+ HF ¾® ДНФ-амино-
| | кислота + пептид
 H R1
H R1
NO2
ДНФ - пептид
С помощью метода Акабори можно получить информацию о С-концевых аминокислотах. Данная реакция основана на гидразинолизе - взаимодействии белков и аминокислот с гидразином в безводной среде при 100оС. Для идентификации N- и C-концевых аминокислот используют также карбоксипептидаз-
ный и аминопептидазный методы.
1. Биуретовая реакция (реакция Пиотровского)
Биуретовая реакция - универсальная цветная реакция, показатель наличия пептидных связей в соединении. Свое название реакция получила от производного мочевины - биурета (лат. bi – два + греч. uron – моча), молекула которого состоит из двух остатков мочевины. Биурет образуется при нагревании сухой мочевины с отщеплением NH3, в щелочной среде переходит в енольную форму:
t
H2N – C – NH2 + H2N – C – NH3 ® NH3 + H2N – C – NH – C – NH2 ® || || || ||
O O O O
Мочевина Мочевина Биурет (кетоформа)
®HN = C – N – C =NH
| | |
OH H OH
Биурет (енольная форма)
Молекула биурета содержит две пептидные группировки – СО – NH -.
В щелочной среде биурет за счет пептидных связей образует окрашенный комплекс с CuSO4, поэтому реактив CuSO4 + NaOH + NaKC4H 4O 6 (cегнетова соль) называется биуретовым
реактивом. Биуретовую реакцию дают соединения, которые содержат не менее двух пептидных связей. Белки, полипептиды, олигопептиды, как и биурет, образуют солеобразные биуретовые комплексы красно-фиолетового и сине-фиолетового цвета с биуретовым реактивом, поэтому данная реакция на белки называется биуретовой реакцией.
Биуретовая реакция характеризует степень гидролиза белков, полный гидролиз белка до аминокислот фиксируется отсутствием биуретовой реакции.
Биуретовую реакцию могут давать небелковые вещества: оксамид (H2N – CO – CO – NH2), ряд аминокислот (гистидин, серин, треонин, аспарагин).
Рассмотрим механизм этой реакции. Для пептидной связи характерна кетоформа; енольная форма редко встречается в пептидах. В щелочной среде из
кетотаутомера (изомера) образуются енольные формы:
H
| OH-
H2N – CH – C – N – CH… С – СOOH ®
| || | |
R1 O H Rn
Таутомерная форма
(кетоформа)
OH
|
H2N – CH – C = N – CH….СOOH Енольная форма
| |
R1 Rn
R2 O H
| || |
H2N – CH- C- N- CH – C – N – CH – C – N – CH – C – N – CH … ®
| || | | || | | || | |
R1 O H R3 O H R4 O H R5
R2 OH
NaOH | |
® H2N – CH – C = N – CH – C = N - CH – C = N – CH – C = N = CH … +
| | | | | | |
R1 OH Енольная форма R3 OH R4 OH R5
полипептида
R2
|
 + 2NaOH + Cu(OH)2 ® C = N – CH – C = N – CH - R3
+ 2NaOH + Cu(OH)2 ® C = N – CH – C = N – CH - R3


 | |
| |


 R1 - CH O O C – O - Na
R1 - CH O O C – O - Na
 | |
| |
 N H2 N
N H2 N
Cu |
 R4 – CH
R4 – CH
|
C – O – Na
||
Биуретовый медный N
комплекс |
сине-фиолетового цвета CH - R5
В сильнощелочной среде происходит диссоциация ОН – групп енольной формы. Енольная форма полипептида дает отрицательный заряд, с помощью которого кислород, взаимодействуя с медью, образует ковалентные связи. Кроме того, медь образует дополнительные координационные связи с атомами азота.
Образование ковалентной связи меди с N – атомами характерно для биуретовой реакции с гистидином:
COONa COONa
| |
CH – NH2 CH - N H2
| |
CH2 CH2
| |





 N N
N N


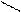
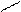
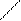

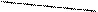
 N Cu N
N Cu N
Медный биуретовый комплекс с гистидином







N
Оборудование, реактивы.
Пробирки; белок яичный (1%- й раствор); желатина (0,1 %-й раствор); биурет (1%-й раствор).
Водная вытяжка из мышечной ткани; реактив биуретовый.
Для приготовления биуретового реактива 1,5 г. CuSO4.5H2O и 6 г. NaKC4H4O6. 4 H2O (сегнетова соль, тартрат, или виннокислый натрий-калий) растворяют в 500 мл H2O, при энергичном перемешивании приливают 300 мл 10 %-го NaOH (свободного
от Na2CO3), добавляют 1 г. KJ, доводят объем дистиллированной водой до 1л. Хранят в парафинированной или полиэтиленовой склянке.
Берут четыре пробирки. В одну пробирку наливают 1 мл 1%-го раствора белка, во вторую - 1 мл 0,1%-го раствора желатины, в третью – 1 мл водной вытяжки из мышечной ткани, в четвертую – 1 мл раствора биурета. В каждую пробирку добавляют по 1 мл свежеприготовленного биуретового реактива. Содержимое пробирок тщательно перемешивают.
Появление сине-фиолетового окрашивания свидетельствует об образовании биуретового комплекса и подтверждает наличие
пептидных связей.
Оформляют результаты.
2. Нингидриновая реакция
Нингидриновая реакция – универсальная цветная реакция; формула нингидрина (трикетогидринденгидрата) выглядит следующим образом:





 =О
=О
нингидрин

 = O
= O
||
O

Нингидриновая реакция характерна для аминогрупп,
находящихся в a- положении и входящих в состав белков, полипептидов, олигопептидов, свободных аминокислот. a-аминокислоты, полипептиды и белки при кипячении с разбавленным водным раствором нингидрина дают синее и сине-фиолетовое окрашивание. При взаимодействии a-аминокислоты с нингидрином образуется шиффово основание, которое перегруппировывается, декарбоксилируется, в итоге образуется аминодикетогидринден, альдегид и CO2. Аминодикетогидринден конденсируется еще с одной молекулой
нингидрина. Образующееся соединение, енолизируясь, переходит в сине-фиолетовый комплекс Руэмана (продукт конденсации мурексидного строения).
R
= O |




 + H2N – CH – COOH ®
+ H2N – CH – COOH ®


 = O
= O
a-аминокислота
||
Нингидрин O




 O
O
||
®


 = N – CH – COOH + H2O
= N – CH – COOH + H2O
|
|| R
O
Шиффово основание




 = O
= O
Перегруппировка Декарбоксилиро-


 - N = C – COOH + вание
- N = C – COOH + вание


 |
|
R
|| H
O




 = O
= O

 ® + H2O
® + H2O
 СH - N = CH +
СH - N = CH +
|| |
O R





 O
O
||
® Аминодикетогидринден


 H
H
NH2
||
O





 O O
O O

 || ||
|| ||



 -H2O
-H2O
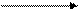 +
+




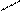

 H O=
H O=
NH2
|| ||
O O
Аминодикетогидринден Нингидрин





 O O
O O

 || ||
|| ||




® + ®






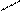

 N
N
H
|| ||
O O





 OH O
OH O

 || ||
|| ||





® + ®





 N =
N =
|| ||
O O



 O = O
O = O


 | ||
| ||






 |


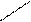


 - N =
- N =
|| ||
O O
Сине-фиолетовый комплекс Руэмана, ДИДА
(продукт конденсации мурексидного строения,
или пурпур Руэмана)
Второй вариант механизма реакции:
O

 ||
||


 H2N – CH – C = O +
H2N – CH – C = O +


 | | + H2O
| | + H2O
 R OH = O
R OH = O
a-аминокислота
||
O
Нингидрин



 - OH
- OH


 NH3 + R – C = O + CO2 +
NH3 + R – C = O + CO2 +
 |
|


 H OH
H OH
Альдегид ||
O
Нингидрин восстановленный
(енольная форма)
 |  | ||








 = O HO -
= O HO -
 |  |
 + +NH3
+ +NH3

 = O HO-
= O HO-
|| ||
O O
Нингидрин окисленный Нингидрин
Восстановленный









 = O HO -
= O HO -



 2H2O +
2H2O +
 |

 = N
= N
|| ||
· O O
Комплекс Руэмана (мурексид
синего цвета)
Оборудование, реактивы:
Пробирки; баня водяная; белок яичный (1%-й раствор); водная вытяжка из
мышечной ткани; нингидрин (0,5 %-й раствор в органическом растворителе – ацетоне).
В первую пробирку вносят 1 мл раствора белка, во вторую – 1 мл раствора желатины, в третью – 1 мл водной вытяжки из мышечной ткани, в каждую добавляют по 0,5 мл раствора нингидрина. Пробирки нагревают до кипения на водяной бане. Через 2-3 мин. Во всех пробирках появляется сине-фиолетовое окрашивание.
3. Ксантопротеиновая реакция (реакция Мульдера)
Ксантопротеиновая (греч. – xanthos – желтый) реакция – реакция на циклические аминокислоты. При нагревании раствора белка с концентрированной азотной кислотой жидкость окрашивается в лимонно-желтый цвет, переходящий при добавлении щелочи в оранжевый. Реакция обусловлена наличием в белке циклических аминокислот (фенилаланина, тирозина, триптофана), которые при взаимодействии с концентрированной азотной кислотой образуют нитропроизводные желтого цвета - (реакция нитрования). Нитропроизводные при добавлении щелочи превращаются в соли хиноидной структуры, окрашенные в оранжевый цвет.
Белки и полипептиды, в состав которых не входят циклические аминокислоты, не дают ксантопротеиновой реакции. К таким соединениям относятся желатина, а также клупеин, сальмин, которые являются протаминами из спермы рыб. Ксантопротеиновую реакцию (появление желтой окраски) можно наблюдать на коже, ногтях, шерсти при попадании концентрированной азотной кислоты.
Схема ксантопротеиновой реакции:
OH OH NO2
 | |
| |

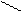
 O3N
O3N
 | |||
 | |||
 + 2HNO3
+ 2HNO3


|
CH2 – CH – COOH |
| CH2
NH2 |
NH2 - CH
|
Тирозин COOH
Динитротирозин
O O

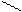

 O2N || || N-ONH4
O2N || || N-ONH4



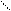
 | = N – OH O2N || O ONH4
| = N – OH O2N || O ONH4  || = N ONH4 O + H2 O
|| = N ONH4 O + H2 O


 + NH4OH ||
+ NH4OH ||
O
| |
CH2 – CH – COOH CH2
| |
NH2 COOH – CH- NH2
Динитротировин
(хиноидная форма) Аммонийная соль
динитротирозина
хиноидной струк-
туры
Оборудование, реактивы:
Пробирки; баня водяная; кислота азотная (конц.); гидроксид натрия (30%-й водный раствор); белок яичный (1%-й раствор);
желатина (1%-й раствор); водная вытяжка из мышечной ткани;
тирозин (1%-й раствор).
В первую пробирку наливают 1 мл 1%-го раствора яичного белка, во вторую – 1 мл 1%-го раствора желатины, в третью – 1 мл водной вытяжки из мышечной ткани, в четвертую – 1 мл раствора тирозина. Во все пробирки добавляют по 0,5 мл концентрированной азотной кислоты и осторожно нагревают. В пробирках с белком, содержащим циклические аминокислоты, и тирозином появляется лимонно-желтое окрашивание. В пробирке с желатиной появляется едва заметное бледно-желтое окрашивание из-за примесей других белков.
Пробирки охлаждают, затем осторожно добавляют в каждую по 1,5 мл
30%-го раствора NaOH. В пробирках с циклической аминокислотой и белком, содержащим циклические аминокислоты, наблюдается переход желтой окраски в оранжевую.
4. Реакция на тирозин (реакция Миллона)
Реакция Миллона является качественной реакцией на ароматическую аминокислоту тирозин. При нагревании растворов белков, в состав которых входит тирозин, с реактивом Миллона образуется осадок белка, окрашенный в кроваво-красный цвет. Реактив Миллона – смесь азотнокислой и азотистокислой солей закиси ртути (HgNO3 и HgNO2), растворенных в концентрированной азотной кислоте.
Белки, которые не содержат тирозина, не дают реакции Миллона (например, желатина, клупеин, сальмин). При взаимодействии реактива Миллона с раствором тирозина осадок не образуется, лишь раствор за счет ртутной соли нитропроизводного приобретает красный цвет.
Реакцию Миллона дают фенолы, полифенолы, алкалоиды, содержащие фенольную группировку.
К раствору белка не следует добавлять избыток реактива Миллона, так как он содержит HNO3, которая при взаимодействии с белком может дать ксантопротеиновую реакцию (желтая окраска), маскирующую реакцию Миллона:
OH O
 | ||
| ||

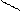


 O2N = = N-OHg
O2N = = N-OHg

 + HgNO3 + HNO3 ||
+ HgNO3 + HNO3 ||

 О
О
|
CH2 – CH – COOH CH2 – CH - COOH
| |
NH2 NH2
Тирозин Ртутная соль
Динитротирозина
Оборудование, реактивы:
Пробирки; тирозин; (1%-й раствор); белок яичный (1%-й раствор); желатина (0,1%-й раствор); водная вытяжка из мышечной ткани рыбы; реактив Миллона.
Реактив Миллона готовят следующим образом: в 60 мл концентрированной HNO3 (r = 1 г/мл) растворяют 40 г ртути при комнатной температуре, затем помещают в теплую водяную баню до прекращения выделения бурых паров окислов азота и перемешивают. Далее добавляют 300 мл воды.
В одну пробирку наливают 0, 5 мл 1%-го раствора яичного белка, во вторую – 0,5 мл 0,1 %-го раствора желатины, в третью – 0,5 мл водной вытяжки из мышечной ткани. Во все пробирки добавляют по 5 капель реактива Миллона и осторожно нагревают.
В пробирках с белком, содержащим тирозин, осадок белка приобретает красное окрашивание. В пробиркой с желатиной осадок растворяется, и жидкость остается бесцветной.
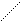
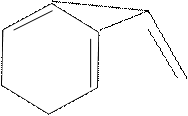
5. Реакция на триптофан (реакция Адамкевича)
Триптофан является гетероциклической a-аминокислотой. В кислой среде он реагирует с формальдегидом, выделяющимся из глиоксиловой кислоты под воздействием концентрированной H2SO4, образуя продукты конденсации красно-фиолетовой окраски. Глиоксиловая кислота O = C – C = O является
| |
HO OH
альдегидокислотой. Она всегда присутствует в виде примеси в ледяной уксусной кислоте, поэтому уксусную кислоту CH3COOH используют в реакции Адамкевича как источник глиоксиловой кислоты. Растворы белков, содержащих триптофан, при взаимодействии с глиоксиловой кислотой в присутствии концентрированной H2SO4 также приобретают красно-фиолетовую окраску.
 O = C – C = O H2SO4 CO2 + H – C = O
O = C – C = O H2SO4 CO2 + H – C = O
| | |
HO OH H
Глиоксиловая кислота Формальдегид
COOH COOH
| |
CH – NH2 CH – NH2
| |

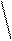 CH2 CH2
CH2 CH2
 | |||
 | |||

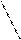

 H
H



 + C = O +
+ C = O +

 H
H
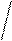


NH NH
Триптофан Триптофан
COOH COOH
| |
CH - NH2 CH - NH2
| |
 CH2 CH2
CH2 CH2












 |  |



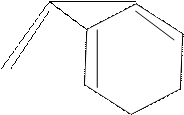
 CH2 + H2O
CH2 + H2O




| |
NH NH
Бис-2-триптофанилметан
Бис-2-триптофанилметан окисляется до бис-2-триптофанилкарбинола, который в присутствии минеральных кислот образует красно- или сине-фиолетовые комплексы:
СООН
COOH |
| CH - NH2
 H2N - CH
H2N - CH
| CH2


 CH2
CH2
 | |||
 | |||
Окисление






 CH2
CH2
 | |||
 | |||
| |
NH NH
COOH
COOH |
| CH - NH2
 H2N - CH
H2N - CH
| CH2


 CH2
CH2
 | |||
 | |||
Окисление




 CH
CH


 |
|
| OH |
NH NH
Бис-2-триптофанилкарбинол
Оборудование, реактивы:
Пробирки; баня водяная; белок яичный (1%-й раствор); желатина (1%-й раствор); кислота уксусная, содержащая глиоксиловую кислоту (конц.); кислота серная (конц.); водная вытяжка из мышечной ткани.
В одну пробирку наливают 0,5 мл 1%-го раствора белка, в другую - 0,5 мл 1%-го раствора желатины, в третью – 0,5 мл водной вытяжки из мышечной ткани. В каждую пробирку добавляют по 0,5 мл концентрированной уксусной кислоты, содержащей глиоксиловую кислоту. Пробирки слегка нагревают на водяной бане, охлаждают. Наслаивают в каждую пробирку по стенкам по 1 мл концентрированной серной кислоты. В пробирках с белком, содержащим триптофан, на границе двух слоев жидкости наблюдается образование красно-фиолетового кольца. В пробирке с желатиной изменения окраски не происходит, так как желатина не содержит триптофана.
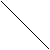
6. Реакция на триптофан (реакция Шульца- Распайля)
Триптофан и белки, содержащие триптофан, реагируют с альдегидами, образуя продукты конденсации красно-фиолетового цвета. Если к раствору белка добавить сахар, затем осторожно, по стенке пробирки, спускать из пипетки концентрированную серную кислоту, то на границе двух жидкостей образуется красно-фиолетовое кольцо. Это объясняется взаимодействием триптофана с оксиметилфурфуролом, образующимся из фруктозы. Сахароза является дисахаридом; при расщеплении одной молекулы сахарозы образуются молекулы фруктозы и глюкозы.
+ H2O
 C12H22O11 C 6 H12O 6 + C 6 H12O 6
C12H22O11 C 6 H12O 6 + C 6 H12O 6
Сахароза Фруктоза Глюкоза
O
O || O



 || N – C ||
|| N – C || 
 СН2ОН
СН2ОН

 Н CH2OH
Н CH2OH

 HOH2C H2SO4
HOH2C H2SO4
 OH - 3 H2O
OH - 3 H2O
 H OH
H OH


 | |
| |
OH H H H
Фруктоза Оксиметилфурфурол
 O
O 
 CH2OH
CH2OH
 ||
||
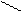





 CH2 - CH – COOH H - C
CH2 - CH – COOH H - C




 2 NH2 + |
2 NH2 + |

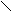
 NH
NH
H H
Триптофан Оксиметилфурфурол
COOH
|
CH – NH2
|


 COOH CH2
COOH CH2

 |
|
 CH – NH2
CH – NH2


 |
|


 CH2
CH2




 NH
NH



 NH H O CH2OH
NH H O CH2OH


 Триптофан
Триптофан
H H
Продукт конденсации красно-фиолетовой окраски
Оборудование, реактивы:
Пробирки; белок яичный (1%-й раствор); кислота серная (конц.); раствор сахарозы.
В пробирку наливают 1 мл 1%-го раствора белка, добавляют 1 мл раствора сахарозы, далее осторожно, по стенке пробирки, наслаивают 0,5 мл концентрированной серной кислоты. На границе двух жидкостей появляется красно-фиолетовое кольцо.
7. Реакция на гистидин (реакция Паули)
Реакция Паули – диазореакция на гистидин и тирозин. При добавлении диазореактива к щелочному раствору белка появляется оранжево-красное окрашивание. Гистидин и тирозин при взаимодействии с диазобензосульфокислотой образуют азокраситель красного цвета:

 O
O



 N CH2 – CH - COOH ||
N CH2 – CH - COOH ||




 | 2O= S NH2 - N= N +
| 2O= S NH2 - N= N +

 NH2 O
NH2 O
 | |||||
 |  | ||||
NH
Гистидин Диазобензолсульфокислота
H2N – CH -COOH
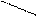
 N CH2
N CH2




 O
O
||

 2015-06-26
2015-06-26 19265
19265
