Основной закон химической кинетики.
Химическая кинетика и катализ
Требования Германии на присоединение Судетской области Чехословакии.
-март – август 1939 г.- переговоры между СССР, Великобританией и Францией о заключении
трехстороннего договора (у партнеров по переговорам не было доверия, каждая из сторон
стремилась получить преимущества; в августе переговоры зашли в тупик).
Сталин чувствовал, что ни Франция, ни Великобритания, не готовы на подписание серьезного договора. Тем более летом 1939 года между Великобританией и Германией начинаются тайные переговоры.Советское правительство пошло на сближение с Германией, с поста наркома иностранных дел был смещен Литвинов. Советский Союз боялся остаться один на один с Германией.
23 августа 1939 года министр иностранных дел Германии Риббентроп и министр иностранных дел СССР Молотов подписали в Москве Договор о ненападении сроком на 10 лет (Пакт Молотова-Риббентропа).К Пакту прилагался секретный протокол. Он разграничивал сферы влияния СССР и Германии в Восточной Европе. В советской сфере оказались Латвия, Эстония, Восточная Польша (Западная Украина и Западная Белоруссия), Финляндия, Бессарабия, в немецкой Западная Польша и Литва.
Многие склонны считать, что подписание пакта было необходимой мерой, направленной на то, чтобы оттянуть втягивание не подготовленного к войне СССР в военный конфликт с Германией. Другие считают этот договор преступным, так как в тайне от всех были поделены территории независимых государств и после подписания этого договора началась Вторая Мировая война.
Химическая кинетика – раздел физической химии, в котором изучается скорость и механизм химических реакций, а также зависимость скорости реакции от различных факторов: природы и концентрации реагирующих веществ, температуры, давления, присутствия катализаторов и др.
Скорость химической реакции – изменение концентрации одного из реагирующих веществ в единицу времени.
Различают среднюю 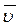 (за промежуток времени D t) и истинную u (в момент времени t) скорости:
(за промежуток времени D t) и истинную u (в момент времени t) скорости:
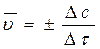 ;
; 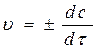 ,
,
где с – концентрация реагирующего вещества.
Поскольку вещества в реакции участвуют в стехиометрическом соотношении, скорость реакции можно определять по изменению концентрации любого вещества, участвующего в реакции. Как правило, скорость определяют по веществу, концентрацию которого легче определить каким-либо химическим или физико-химическим методом.
Например, для реакции
a A + b B = e E + l L (1)
выражения скорости по конкретному веществу запишутся:
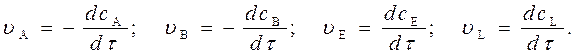
Скорость реакции всегда положительна, поэтому для исходных веществ, концентрация которых с течением времени убывает, перед производной ставится знак минус.
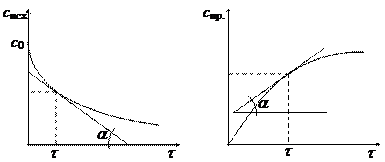 Скорость реакции в момент времени t равна тангенсу угла наклона касательной, проведенной к кинетической кривой с = f (t) в точке, соответствующей времени t (см. рис.):
Скорость реакции в момент времени t равна тангенсу угла наклона касательной, проведенной к кинетической кривой с = f (t) в точке, соответствующей времени t (см. рис.):
u = tg a.
Изменения концентраций каждого из реагентов связаны друг с другом стехиометрическими соотношениями. Тогда для реакции (1)
скорость можно выразить
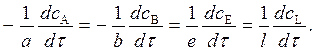
Основной закон химической кинетики (ОЗХК) описывает зависимость скорости реакции от концентрации реагирующих веществ: скорость химической реакции в каждый момент времени пропорциональна текущим концентрациям реагирующих веществ, возведенным в некоторые степени.
Для реакции (1) математическое выражение ОЗХК запишется:
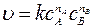 , (2)
, (2)
где с А, с В – текущие (в момент времени t) концентрации реагирующих веществ; n А, n В – эмпирические коэффициенты, называемые частными порядками реакции по веществам А и В; k – константа скорости химической реакции, численно равна скорости реакции при концентрациях реагирующих веществ, равных 1.
Константа скорости реакции зависит только от природы реагирующих веществ и температуры и не зависит от их концентрации, т.е. при постоянной температуре k остается постоянной величиной в течение всей реакции (в отличие от скорости).
Порядок реакции n равен сумме частных порядков:
n А + n В = n.
Порядок реакции может быть целым, дробным числом и равным 0.
Большинство химических реакций протекают в несколько стадий, называемых элементарными. Самая медленная стадия определяет скорость всей реакции и называется лимитирующей. Элементарная реакция состоит из большого числа однотипных актов химического превращения.
Молекулярность реакции – число молекул, участвующих в элементарном акте химического превращения. Молекулярность реакции – всегда целое положительное число, равное 1, 2 и реже 3.
Мономолекулярные реакции – элементарные реакции распада и изомеризации, в которых участвует только одна молекула, например,
А ® В.
В бимолекулярных реакциях происходит столкновение двух частиц, это самый распространенный тип реакций, например,
А + В ® D.
В тримолекулярных реакциях одновременно сталкиваются три частицы, например,
А + В +С ® D.
Вероятность одновременного столкновения четырех и более частиц ничтожно мала.
Для элементарных реакций общий порядок равен молекулярности, а частные порядки – стехиометрическим коэффициентам уравнения реакции. Для сложных реакций порядок и молекулярность могут сильно различаться.
 2014-02-12
2014-02-12 1831
1831