Температура сильно влияет на скорость химической реакции. В соответствии с эмпирическим правилом Вант-Гоффа при увеличении температуры на каждые 10 °С скорость простых химических реакций увеличивается в 2 – 4 раза.
Математическое выражение правила Вант-Гоффа:
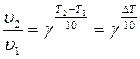 ,
,
где g – температурный коэффициент скорости химической реакции (g = 2¸4),
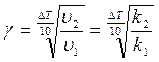 .
.
u 1, u 2 – скорость реакции при температуре Т 1 и Т 2 соответственно.
Например, если при повышении температуры на 60 °С скорость реакции возросла в 64 раза, то температурный коэффициент g равен
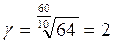 .
.
Более точно влияние температуры на скорость простых химических реакций писывает уравнение Аррениуса:
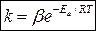 , (12)
, (12)
где b – предэкспоненциальный множитель, в небольшом интервале температур
b = const; Еа – энергия активации.
Энергия активации – это избыточная энергия микрочастиц относительно среднего энергетического уровня системы, необходимая для того, чтобы произошло химическое взаимодействие.
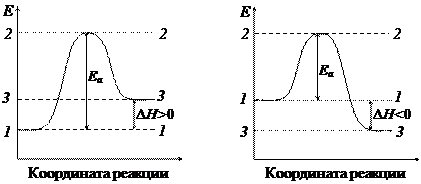
Эндотермические реакции Экзотермические реакции
1-1 – средний энергетический уровень микрочастиц в реакторе;
2-2 – энергетический уровень, на котором происходит химическое взаимодействие;
3-3 – энергетический уровень микрочастиц продуктов реакции.
Чем выше энергия активации, тем медленнее протекает реакция.
Энергию активации реакции можно найти, если известны константы скорости данной реакции при нескольких температурах. Зависимость k = f(T) может быть установлена экспериментально. Уравнение Аррениуса (12) удобно привести к линейному виду, прологарифмировав левую и правую части:
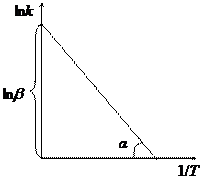
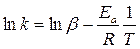 .
.
Из полученного уравнения следует, что для любой химической реакции зависимость ln k от 1 / Т описывается прямой линией (см. рис.). Тангенс угла наклона прямой равен
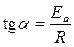 ,
,
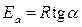 .
.
Если известны константы скорости при двух температурах, то можно найти некоторое среднее значение энергии активации в заданном интервале температур:
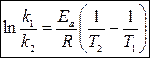 .
.
 2014-02-12
2014-02-12 1470
1470