С точки зрения учения о кинетике все химические реакции обратимы, т.е. превращения протекают как в прямом, так и в обратном направлении, но с разными скоростями. Когда скорости прямой и обратной реакций станут равными, наступает состояние химического равновесия.
При определенных условиях, например, когда продукты выводятся из сферы реакции, реакции могут протекать только в одном направлении. Это необратимые, или односторонние, реакции.
Рассмотрим простые необратимые реакции целого порядка.
Пусть в уравнении (2) скорость определяется по изменению концентрации вещества А, т.е.
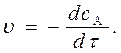
Реакции нулевого порядка (n = 0).
В этом случае
n А + n В = 0
и основной закон химической кинетики (2) запишется:
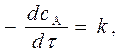 (3)
(3)
т.е. скорость реакций нулевого порядка не зависит от концентрации реагирующих веществ, например, фотохимические реакции, в которых определяющим фактором служит количество поглощенного света, а не концентрация.
Разделим переменные в (3) и проинтегрируем в определенных пределах:
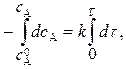
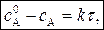 (4)
(4)
где 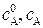 – начальная (при t = 0) и текущая (в момент времени t) концентрации реагирующего вещества.
– начальная (при t = 0) и текущая (в момент времени t) концентрации реагирующего вещества.
Уравнение (4), записанное в виде
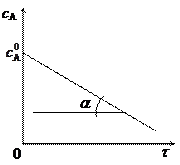
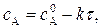
представляет собой уравнение прямой линии, тангенс угла наклона прямой равен k:
k = tg a.
Размерность k совпадает с размерностью скорости:
[ k ] = [ u ] = моль/(дм3×с).
В кинетические уравнения время можно подставлять в любых единицах измерения (в секундах, минутах, часах, сутках, годах), что отражается в единицах измерения k.
Реакции первого порядка (n = 1).
Один из частных порядков равен 1, второй – 0:
n А = 1, n В = 0,
основной закон химической кинетики (2) запишется:
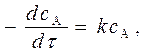 (5)
(5)
Разделим переменные и проинтегрируем:
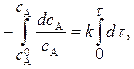
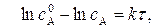 (6)
(6)
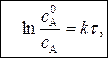 (7)
(7)
Линейная форма уравнений (6), (7) имеет вид:
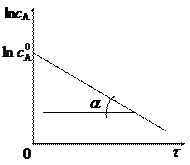
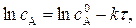
тангенс угла наклона прямой равен k:
k = tg a.
Линейная зависимость 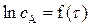 используется для определения k по экспериментальным данным.
используется для определения k по экспериментальным данным.
Размерность k:
[ k ] = с-1.
В кинетике реакций 1-го порядка широко используется понятие времени (периода) полупревращения t 1/2– время, за которое прореагирует половина исходного вещества.
Когда t = t 1/2, то 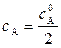 . Подставим в (7):
. Подставим в (7):
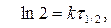
следовательно, 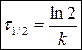 ,
,
т.е. для реакций 1-го порядка время полупревращения не зависит от исходной концентрации реагирующих веществ.
Реакции второго порядка (n = 2).
Возможны два случая.
1) n А = 2, n В = 0 – скорость зависит от концентрации только одного вещества,
или n А = n В = 1, но с А = с В, т.е. текущие концентрации реагирующих веществ равны.
В этом случае уравнение (2) запишется:
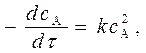 (8)
(8)
Разделим переменные и проинтегрируем:
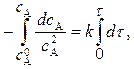
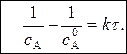 (9)
(9)
Линейная форма уравнения (9) имеет вид:
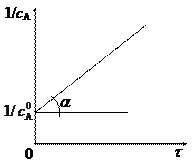
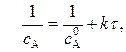
и используется для определения k по экспериментальным данным:
k = tg a.
Размерность k:
[ k ] = дм3(моль×с).
2) n А = n В = 1, но с А ¹ с В.
В этом случае
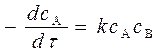 . (10)
. (10)
В уравнении (10) независимая переменная t и две зависимые переменные с А и с В. Для решения этого уравнения его необходимо дополнить соотношением, связывающим с А и с В друг с другом, полученным из стехиометрического соотношения веществ в уравнении реакции.
Рассмотрим простейший случай, когда в реакцию (1) вступает 1 моль вещества А и 1 моль вещества В:
A + B = e E + l L.
Пусть Х – убыль концентрации вещества А к моменту времени t. В соответствии с уравнением реакции убыль концентрации вещества В также составит Х.
Тогда текущие концентрации, выраженные через Х, запишутся:
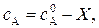
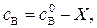
где 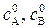 – исходные концентрации веществ А и В.
– исходные концентрации веществ А и В.
После подстановки в (10)
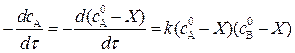 ,
,
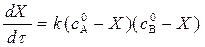 . (11)
. (11)
Решение уравнения (11) имеет вид:
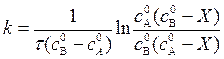 .
.
 2014-02-12
2014-02-12 1113
1113
