Кинетика ферментативных процессов
Катализатор – вещество, которое ускоряет реакцию, но само оно в ней не расходуется. Реакции, катализирующиеся ферментами, обычно характеризуются сильным ускорением (порядка 104 – 105 раз) и высокой специфичностью. Под специфичностью понимают способность ферментов ускорять реакцию только между определенными веществами, которые называются субстратами.
Все ферменты представляют собой белковые молекулы, которые содержат один или несколько активных центров, где и происходит превращение субстратов. Структура активного центра может быть образована всего несколькими аминокислотными остатками. Остальная часть белковой молекулы необходима для поддержания структурной целостности этой рабочей части – активного центра.
При изучении кинетики ферментативных процессов обычно измеряют начальные скорости реакции. Это достигается путем изменения только концентрации субстрата, тогда как все остальные условия опыта поддерживаются постоянными. Для реакций, в которых участвует несколько субстратов, должны также поддерживаться постоянными концентрации всех субстратов, кроме одного. Преимущество такого подхода состоит в том, что при этом не возникает осложнений, зависящих от подавления активности фермента продуктами реакции, изменением конформации фермента, рН среды и температуры, а также возможной обратимостью реакции. На рис. 1.1 показан график зависимости начальных скоростей от концентрации субстрата.
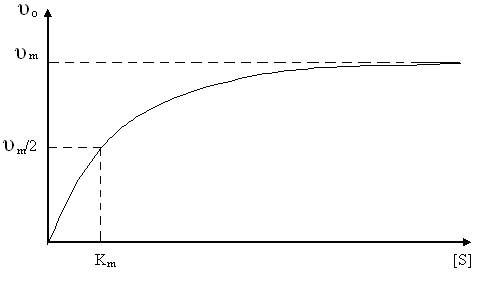
Рис. 1.1. График зависимости начальной скорости реакции υО от концентрации субстрата [S].
В 1913 г. Михаэлисом и Ментен была предложена теория, объясняющая зависимость начальной скорости ферментативной реакции от концентрации субстрата. Они рассмотрели следующую схему процесса:
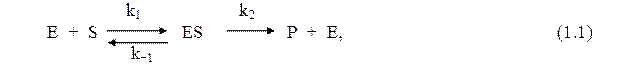
где: E и S – фермент и субстрат соответственно; ES – фермент-субстратный комплекс, Р – продукт реакции. Начальная скорость υО образования продукта дается уравнением:
d[P]
υО = ——— = k2 ∙ [ES]. (1.2)
dt
Концентрацию фермента и субстрата в любой момент времени t после начала реакции можно представить в виде:
[E] = [E]О − [ES]; [S] = [S]О – [ES],
где: [E]О и [S]О - начальные концентрации фермента и субстрата соответственно, [ES] – концентрация фермент-субстратного комплекса.
Однако, условия опыта обычно таковы, что [S]О >> [E]О, поэтому [S]О >> [ES] или [S] ≈ [S]О. Михаэлис и Ментен предположили, что k−1 >> k2, так что первая стадия (образование комплекса ES) может рассматриваться как процесс быстрого установления равновесия. Константа диссоциации КS записывается в виде:
k−1 [E] ∙ [S] ([E]О − [ES]) ∙ [S]
КS = —— = ———— = ————————. (1.3)
k1 [ES] [ES]
Решая это уравнение относительно [ES], получаем
[E]О ∙ [S]
[ES] = ——————. (1.4)
КS + [S]
Подстановка последнего уравнения в уравнение для начальной скорости реакции (υО), дает следующее выражение:
d[P] k2 ∙ [E]О ∙ [S]
υО = ——— = ———————. (1.5)
dt КS + [S]
График зависимости υО от [S] представляет собой гиперболу, похожую на кривую, изображенную на рис. 1.1.
Из изложенного ясно, что предположения, использованные Михаэлисом и Ментен, должны выполняться лишь в немногих случаях. Как правило, оказывается, что величина k2 сопоставима или даже превышает величину k−1.
В связи с этим, другие авторы Бриггс и Холдейн в 1925 г. Предложили подход, независящий от относительных величин k−1 и k2. Они применили к процессу, в котором участвует фермент-субстратный комплекс, стационарное приближение.
Согласно данному приближению концентрация фермент-субстратного комплекса не изменяется во времени, то есть d[ES] / dt = 0. Из этого следует:
d[ES]
——— = 0 = k1 ∙ [E] ∙ [S] − k−1 ∙ [ES] − k2 ∙ [ES] =
dt
= k1 ∙ ([E]О − [ES]) ∙ [S] − (k−1 + k2) ∙ [ES]. (1.6)
Решая уравнение относительно [ES], получаем:
k1 ∙ [E]О ∙ [S]
[ES] = ———————.
k1 ∙ [S] + k−1 + k2
Используя последнее уравнение и уравнение для нахождения υО, получаем:
d[P] k1 ∙ k2 ∙ [E]О ∙ [S] k2 ∙ [E]О ∙ [S]
υО = ——— = k2 ∙ [ES] = ———————— = ————————— =
dt k1 ∙ [S] + k−1 + k2 [(k−1 + k2) / k1] + [S]
k2 ∙ [E]О ∙ [S]
= ———————, (1.7)
Km + [S]
где: Km – константа Михаэлиса, которая определяется следующим образом:
k−1 + k2
Km = ————. (1.8)
k1
Сравнивая уравнения для нахождения величин υО и Km, можно видеть, что они содержат одинаковую зависимость от концентрации субстрата, однако в общем случае Km ≠ КS. Равенство выполняется только при k−1 >> k2.
В кинетических исследованиях оказывается полезной величина максимальной скорости реакции υm. Это такая скорость, с которой реагируют молекулы фермента, находящиеся в составе комплекса ES, то есть при равенстве [E]О = [ES]. Из уравнения (1.2) находим:
d[P]
υО = ——— = k2 ∙ [ES], из этого
dt
υm
следует, что υm = k2 ∙ [E]О или [E]О = ———.
k2
Подставляя [E]О в уравнение (1.7), получаем уравнение Михаэлиса – Ментен:
υm ∙ [S]
υО = ————. (1.9)
Km + [S]
Уравнение (1.9) имеет два предельных случай. При низкой концентрации субстрата Km >> [S] и скорость описывается уравнением первого порядка относительно [S]:
υm ∙ [S]
υО ≈ ————. (1.10)
Km
При высокой концентрации субстрата [S] >> Km скорость реакции имеет нулевой порядок относительно [S]: υО ≈ υm.
Эти два случая относятся и к начальной фазе, и к последующим периодам времени для кривой, приведенной на рис. 1.1. Из этого графика можно также получить величину Km, поскольку при υО = υm / 2 уравнение (1.9) дает
υm υm ∙ [S]
—— = ———— или Km = [S]. (1.11)
2 Km + [S]
 2014-02-12
2014-02-12 4077
4077