Кинетика ферментативных процессов (продолжение)
Результаты измерений начальных скоростей при различных концентрациях субстрата удобнее всего представлять графически, с тем, чтобы можно было оценить значения кинетических параметров и точность эксперимента. Самый простой способ графического представления данных, описываемых уравнением (1.9):
υm ∙ [S]
υО = ————. (1.9)
Km + [S]
Он состоит в построении графика зависимости υО от концентрации субстрата [S].
Для практических целей этот график оказывается наименее пригодным. Обусловлено это следующим:
- трудно построить равнобочные гиперболы;
- определенные трудности возникают при построении касательных к кривой – их всегда хочется провести как можно ближе к ней;
- трудно проводить сопоставление гипербол между собой.
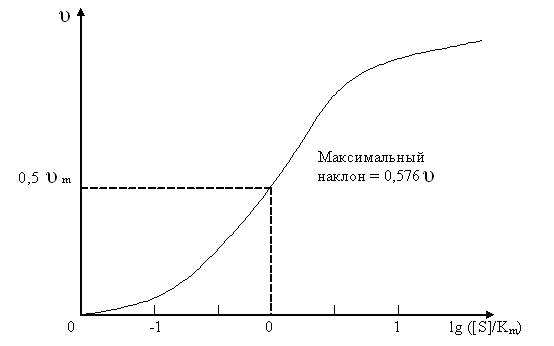
Рис. 1.3.Определение параметров υ и Km методом Михаэлиса и Ментен.
Михаэлис и Ментен строили график зависимости υ – lg([S]/Km) следующим образом (рис. 1.3.). Дифференцирование уравнения (1.9) показывает, что
dυО Km ∙ υm ∙ [S]
——— = ————————, (1.20)
d ln [S] (Km + [S])2
или
dυО 2,303 ∙ Km ∙ υm ∙ [S]
——— = ————————. (1.21)
d lg [S] (Km + [S])2
Максимальный наклон имеет место при [S] = Km; он равен 2,303 ∙ υm / 4, то есть 0,576 υm. Следовательно, υm можно рассчитать, разделив значение максимального наклона на 0,576. Михаэлис и Ментен определяли затем константу Km как значение [S], при котором скорость составляет половину υm.
После опубликования работы Лайнуивера и Бэрка большинство исследователей на практике стали использовать уравнение Михаэлиса – Ментен в форме, позволяющей представить результаты кинетических исследований в виде прямой линии. Линеаризацию можно проводить тремя способами:
[S] Km [S]
—— = ——— + ——, (1.22)
υO υm υm
Km ∙ υO
υО = υm − ————, (1.23)
[S]
1 1 Km
—— = —— + ————. (1.24)
υO υm υm ∙ [S]
В первом случае (1.22) зависимость [S] / υO от [S] графически изображается прямой с наклоном 1/ υm и отсекает на осях [S] / υO и [S] отрезки Km / υm и − Km соответственно (рис. 1.4.). Аналогичным образом, откладывая υO от υO / [S] и 1 / υO от 1 / [S], строят линейные графики зависимостей (1.23) и (1.24). Последние два графика изображены на рисунках 1.5 и 1.6 соответственно.
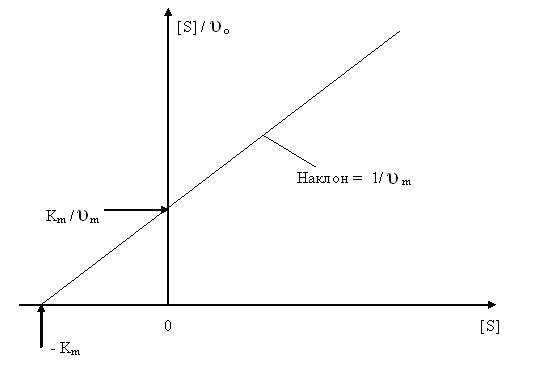
Рис. 1.4.График зависимости [S] / υО от [S].
Наиболее часто применяется график двойных обратных координат (1 / υO и 1 / [S]) Лайнуивера – Бэрка (рис. 1.6.), но он является наименее точным, чем два предыдущих (рис.1.4. и 1.5.). На всех трех графиках понятие наклона прямой подразумевает тангенс угла, образуемого ей с осью абсцисс.
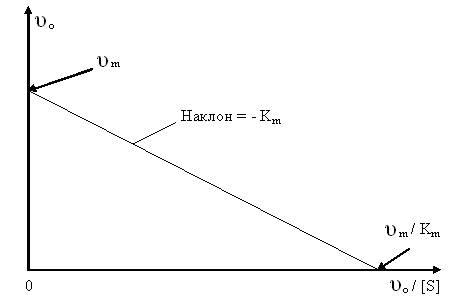
Рис. 1.5.График зависимости υО от υО / [S] (график Эди - Хофсти).
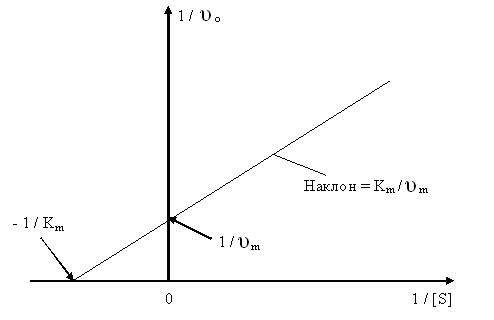
Рис. 1.6.График зависимости 1 / υO от 1 / [S] (график Лайнуивера - Бэрка), или график двойных обратных координат.
Все три приведенные графика (рис. 1.4. – 1.6.) имеют свои недостатки и неточности, однако, имеет смысл использовать наиболее привычный график – график двойных обратных координат Лайнуивера - Бэрка.
Каков смысл величин υm и Km? Смысл максимальной скорости очевиден как теоретически, так и практически. Она представляет собой максимально достижимую скорость, то есть ту скорость, с которой протекает реакция, если весь фермент находится в составе фермент-субстратного комплекса. Кинетическая постоянная k2 в уравнении υm = k2 ∙ [E]O называется числом оборотов фермента. Число оборотов – это количество молекул субстрата, превращаемых в продукт реакции (Р) в условиях, когда весь фермент находится в составе фермент-субстратного комплекса. Например, число оборотов фермента карбоангидразы очень велико, около 6 ∙ 105 с−1. Таким образом, количество фермента, равное 10−6 моль, способно катализировать образование 0,6 моль Н2СО3 из углекислого газа и воды в 1 с, то есть
υm = 6 ∙ 105 с−1 ∙ 10−6 моль = 0,6 моль / с.
Числа оборотов большинства ферментов находятся в интервале 0,5 - 10−4 с−1. Величина Km не имеет такого простого смысла. Только в случае, когда k−1 >> k2, Km можно приравнять константе диссоциации KS. Если это условие выполнено, то Km становится мерой прочности фермент-субстратного комплекса ES: большим значениям Km соответствует слабое связывание субстрата ферментом, малым значениям Km – сильное связывание. Обычно Km можно выразить через три константы скорости, из которых одну константу, k2, в принципе можно получить из уравнения
υm
[E]O = ———.
k2
Можно сказать, что Km – это концентрация субстрата, при которой скорость реакции будет равна половине максимальной скорости (υm).
Тем не менее, значения Km обычно приводят наряду с величинами υm и k2 как количественный параметр ферментативной реакции. Причина состоит в том, что Km зависит от рН среды, температуры, природы субстрата и других факторов. Поэтому ее значение может служить для того, чтобы характеризовать конкретную фермент-субстратную систему в определенных условиях. В большинстве случаев Km находится в интервале от 10−1 до 10−6 моль/л.
 2014-02-12
2014-02-12 3281
3281
