Правило фаз Гиббса. Диаграмма состояния воды
Качественная характеристика гетерогенных равновесных систем, в которых не происходит химического взаимодействия, а наблюдается лишь переход составных частей системы из одного агрегатного состояния в другое, определяется правилом фаз Гиббса. Это правило основано на втором законе термодинамики и относится к системам, находящимся в состоянии истинного равновесия. Введем основные понятия этого правила: фаза, компонент и степень свободы.
Фаза (Ф) – это совокупность гомогенных частей системы, обладающих одинаковыми термодинамическими свойствами (твёрдая, жидкая или газообразная фаза).
Компонент (K) – это химически однородная часть системы, которая при выделении из нее существует в изолированном виде сколь угодно долго. Компонент может находиться в разных фазах.
Число степеней свободы (С) – это число условий, которые можно в системе менять произвольно (давление, температура, состав системы), не нарушая при этом числа и вида фаз данной системы.
Гиббс (1878) вывел следующее уравнение, выражающее условия фазового равновесия:
С + Ф = К + n (6.15)
Это соотношение известно как закон равновесия фаз иназывается правилом фаз. Для конденсированных систем можно пренебречь парообразной фазой, и поэтому n = 1. Применяют для сплавов, например висмут-кадмий. Для неконденсированных систем, в которых учитывают парообразную фазу, n = 2. Применяют для воды, растворов.
Рассмотрим диаграмму состояния воды (рис. 8). Область I характеризует твердую (лед), II – жидкую, а III – парообразную фазу. При этом число фаз равно одному, а система бивариантна, т.е. давление и температура меняются, независимо друг от друга и при этом вода не меняет своего агрегатного состояния.
С = 1+ 2 – Ф = 3 – Ф
если Ф = 1, то С = 2 (система бивариантна)
Ф = 2, то С = 1 (система одновариантна)
Ф = 3, то С = 0 (система безвариантна)
Ф = 4, то С = -1 (не имеет физического смысла)
р
 A B
A B
II 

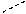 I О III
I О III
Д C
 Т
Т
Рис. 8. Диаграмма состояния воды
Кривая АО характеризует равновесие между льдом и жидкостью (кривая плавления), ВО – между жидкостью и паром (кривая кипения), СО – между льдом и паром (процесс сублимации). При этом число фаз равно двум, система одновариантна, то есть, каждому давлению соответствует строго определенная температура, и наоборот.
Точка О – тройная точка воды, когда в равновесии находятся три фазы: лед, жидкость и пар. Система в этом случае безвариантна. Для воды в тройной точке давление равно 610,6 Па и температура 273,15 К. Кривая ДО характеризует переохлажденную жидкость – метастабильное неустойчивое состояние воды.
Таким образом, при одном компоненте более трех фаз в равновесии находиться не могут, а наибольшее число степеней свободы равно двум, т. е. в системе независимо друг от друга можно менять температуру и давление.
 2014-02-12
2014-02-12 2960
2960
