Электролитические (кондуктометрические) преобразователи. Принцип действия электролитических преобразователей основан на зависимости электропроводности раствора электролита от его концентрации. Как известно, электропроводность дистиллированной воды очень мала. При растворении в ней кислот, солей, оснований (электролитов) электропроводность возрастает. При растворении в воде электролиты диссоциируют на положительные и отрицательные ионы; при этом количество носителей и электропроводность раствора возрастают. При малых концентрациях электролита, когда
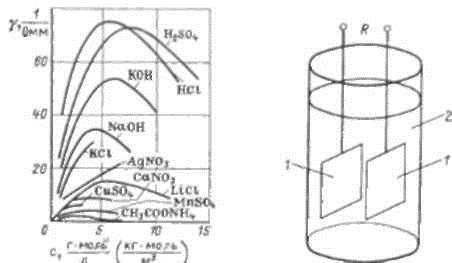
Рис 29 Рис 30
количество ионов мало, увеличение электропроводности пропорционально концентрации растворенного вещества. При увеличении концентрации с в результате взаимодействия между ионами и уменьшения степени диссоциации пропорциональность нарушается (рис. 29).
Электролитический преобразователь (рис 30) представляет собой два электрода 1, погруженные в раствор 2. Электролитические преобразователи в основном применяются для измерения концентрации растворов, кроме того, они используются для измерения перемещения, скорости, механических деформаций, температуры и других физических величин. В преобразователях, предназначенных для измерения концентрации, электроды делаются неподвижными. Сопротивление между электродами преобразователя R обратно пропорционально удельной электрической проводимости электролита:
R = k/y (38)
Коэффициент называется постоянной преобразователя. Он определяется экспериментально по сопротивлению преобразователя, заполненного раствором с известным значением 7.
Гальванические преобразователи. Принцип действия гальванического преобразователя основан на зависимости потенциала электрода от концентрации ионов в растворе. Металлический электрод, погруженный в раствор электролита, частично в нем растворяется. Положительные ионы металла переходят в раствор, и электрод получает отрицательный заряд. Образованная разность потенциалов между электродом и раствором препятствует переходу ионов металла, и растворение электрода прекращается. При равновесии электрический потенциал электрода зависит от концентрации ионов в растворе и может служить для определения их концентрации.
Конструктивно гальванический преобразователь состоит из двух полуэлементов и которые гальванически соединены
между собой электрическим ключом 3. Полуэлемент представляет собой сосуд с раствором электролита, в который погружен металлический электрод. В одном полуэлементе находится раствор, концентрация которого измеряется, в другом — раствор с известной концентрацией. Электролитический ключ — это трубка, заполненная раствором КС1 и закрытая с двух сторон полупроницаемыми пробками из ваты или асбеста. ЭДС преобразователя Е, измеряемая между двумя электродами, определяется неизвестной концентрацией.
Большое значение имеет определение концентрации ионов водорода Н в растворах. Чистая дистиллированная вода, хотя и немного, но диссоциировала на ионы. Согласно закону действующих масс и вследствие малой диссоциации воды ионное произведение воды
k=aH+aOH- (39)
где aH+aOH- — концентрация ионов Н+ и ОН, выраженные в моль/л.
Ионное произведение воды — величина постоянная, при 22 °С равная 10~14. Если в воде растворить кислоту, то при диссоциации ее молекул концентрация ионов Н+ возрастает и, следовательно, уменьшается концентрация ионов ОН-. Растворение оснований изменяет концентрации Н+ и ОН- противоположным образом. Концентрация ионов водорода характеризует кислотность раствора. Кислотность влияет на протекание многих химических реакций, и биохимических процессов. Единицей ее измерения служит водородный показатель
рН = -lgaH+. (39)
Измерение ЭДС гальванических преобразователей должно производиться при минимальном токе, поскольку при протекании тока происходит электролиз и изменяется концентрация раствора в приэлектродной области, что создает погрешность. Кроме того, при протекании тока происходит падение напряжения на довольно большом внутреннем сопротивлении преобразователя, что также вносит погрешность в измерение ЭДС. ЭДС рН-метро в измеряется либо электронными вольтметрами с большим входным сопротивлением, либо с помощью потенциометров с ручным или автоматическим уравновешиванием.
ЭДС гальванического преобразователя зависит от температуры. Для уменьшения погрешности автоматические рН-метры имеют термо-корректирующие цепи.
 2014-02-13
2014-02-13 3375
3375
