В зависимости от природы частиц, помещающихся в узлах кристаллической решетки, и от характера сил взаимодействия между частицами различают четыре типа кристаллических решеток и соответственно четыре типа кристаллов: ионные, атомные, металлические и молекулярные.
I. Ионные кристаллы. В узлах кристаллической решетки помещаются ионы разных знаков. Силы взаимодействия
 |
между ними являются в основном электростатическими (кулоновскими).
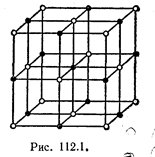
Типичным примером ионной решетки может служить изображенная на рис. 1 решетка каменной соли NаС1. Эта решетка принадлежит к кубической системе. Белыми кружками изображены несущие положительный заряд ионы натрия, черными кружками — отрицательные ионы хлора. Как видно из рисунка, ближайшими соседями иона данного знака будут ионы противоположного знака. В газообразном состоянии NaCl состоит из молекул, в которых объединяются попарно ионы натрия с ионами хлора. Образующая молекулу группировка из иона Na и иона С1 утрачивает в кристалле обособленное существование.
Ионный кристалл состоит не из молекул, а из ионов.
2. А т о м н ы е к р и с т а л л ы. В узлах кристаллической решетки помещаются нейтральные атомы.
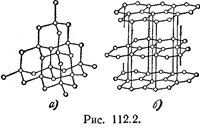
Типичными примерами атомных кристаллов могут служить алмаз и графит. Оба эти вещества тождественны по химической природе (они построены из атомов углерода), но отличаются кристаллическим строением. На рис. 2, а показана решетка алмаза, на рис. 2,6—решётка графита.
Для этой решетки алмаза характерно то, что каждый атом окружен четырьмя равноотстоящими от него соседями, расположенными в вершинах правильного тетраэдра.
 |
3. Металлические кристаллы. Во всех узлах кристаллической решетки расположены положительные ионы металла. Между ними беспорядочно, подобно молекулам газа, движутся электроны, отщепившиеся от атомов при образовании ионов. Эти электроны играют роль «цемента», удерживая вместе положительные ионы; в противном случае решетка распалась бы под действием сил отталкивания между ионами. Вместе с тем и электроны удерживаются ионами в пределах кристаллической решетки и не могут ее покинуть.
4. Молекулярные кристаллы. В узлах кристаллической решетки помещаются определенным образом ориентированные молекулы. Силы связи между молекулами в кристалле имеют ту же природу, что и силы притяжения между молекулами, приводящие к отклонению газов от идеальности.
Молекулярные решетки образуют, например, следующие вещества:
Нг, Na, Оз, СОа, НаО. Таким образом, обычный лед, а также так называемый сухой лед (твердая углекислота) представляют собой молекулярные кристаллы.
 2014-02-13
2014-02-13 1465
1465








