РЕАЛЬНЫЕ ГАЗЫ И ЖИДКОСТИ
Получение вакуума
Высоким вакуумом называют вакуум при давлениях от 0,1Па до 10-5Па. Для его получения осуществляют ступенчатую откачку.
Сначала используют насос предварительного разрежения или форвакуумный насос, в котором используется принцип «выметания» молекул. С помощью форвакуумных насосов можно получить в откачиваемом объёме давления порядка10 ÷ 100 Па.
Для получения высокого вакуума используют струйный или диффузионный насос, который ведёт откачку газа в пространство, предварительно разреженное форвакуумным насосом. Диффузионные насосы не имеют движущихся частей. Откачка происходит благодаря двум эффектам: струя пара увлекает молекулы воздуха за счёт снижения статического давления вблизи струи, а также за счёт диффузии молекул воздуха в область, где находится струя пара.
Измерение низких давлений – тоже сложная задача. При очень низких давлениях от 10 Па до 10-11Па применяют для измерения давления манометры Мак-Леода, термоэлектрические, ионизационные манометры. Более подробно о получении вакуума и измерении малых давлений см. в [1,2,3].
 Учитывая рассмотренные выше характеристики молекулярного движения, можно сформулировать условия идеальности газа следующим образом. Газ можно считать идеальным, если средняя длина свободного пробега молекул много больше эффективного диаметра молекулы (
Учитывая рассмотренные выше характеристики молекулярного движения, можно сформулировать условия идеальности газа следующим образом. Газ можно считать идеальным, если средняя длина свободного пробега молекул много больше эффективного диаметра молекулы ( ). В этом случае среднее время свободного пробега молекул будет много больше длительности соударений (
). В этом случае среднее время свободного пробега молекул будет много больше длительности соударений (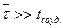 ). Это хорошо выполняется при нормальных условиях и условиях, близких к ним: Т ~273 К,
). Это хорошо выполняется при нормальных условиях и условиях, близких к ним: Т ~273 К, 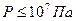 . При повышении давления и понижении температуры средние расстояния между молекулами уменьшаются. Средняя кинетическая энергия молекул становится сравнимой с потенциальной энергией взаимодействия молекул, и поведение газа отличается от идеального. Отклонение свойств газа от идеальности установлено экспериментально при проверке справедливости уравнения Менделеева - Клапейрона.
. При повышении давления и понижении температуры средние расстояния между молекулами уменьшаются. Средняя кинетическая энергия молекул становится сравнимой с потенциальной энергией взаимодействия молекул, и поведение газа отличается от идеального. Отклонение свойств газа от идеальности установлено экспериментально при проверке справедливости уравнения Менделеева - Клапейрона.
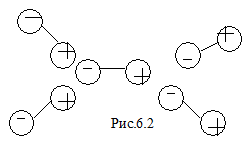 Рассмотрим взаимодействие молекул в реальных газах. В реальных газах между молекулами действуют силы притяжения, называемые силами Ван-дер-Ваальса. Эти силы возникают потому, что при небольшом смещении отрицательного и положительного зарядов в нейтральной молекуле, молекула превращается в диполь – совокупность разноимённых одинаковых по модулю, расположенных близко друг к другу зарядов (рис.6.1). Диполь создаёт в окружающем пространстве электрическое поле, которое действует на соседние диполи.
Рассмотрим взаимодействие молекул в реальных газах. В реальных газах между молекулами действуют силы притяжения, называемые силами Ван-дер-Ваальса. Эти силы возникают потому, что при небольшом смещении отрицательного и положительного зарядов в нейтральной молекуле, молекула превращается в диполь – совокупность разноимённых одинаковых по модулю, расположенных близко друг к другу зарядов (рис.6.1). Диполь создаёт в окружающем пространстве электрическое поле, которое действует на соседние диполи.
Устойчивым будет расположение диполей разными полюсами друг к другу (рис.6.2). Поэтому полярные молекулы притягиваются. На малых расстояниях, сравнимых с эффективным диаметром молекулы, между молекулами действуют силы отталкивания. Потенциальная энергия взаимодействия молекул уменьшается с увеличением расстояния между ними.
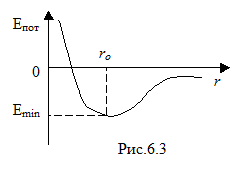 Зависимость потенциальной энергии взаимодействия молекул Епот от расстояния r между ними приведена на рис. 6.3. На расстоянии
Зависимость потенциальной энергии взаимодействия молекул Епот от расстояния r между ними приведена на рис. 6.3. На расстоянии 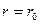 потенциальная энергия взаимодействия молекул минимальна. Это устойчивое состояние молекул. На расстояниях
потенциальная энергия взаимодействия молекул минимальна. Это устойчивое состояние молекул. На расстояниях 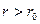 между молекулами преобладают силы притяжения, а потенциальная энергия взаимодействия отрицательна. На расстояниях
между молекулами преобладают силы притяжения, а потенциальная энергия взаимодействия отрицательна. На расстояниях 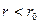 между молекулами преобладают силы отталкивания, а потенциальная энергия взаимодействия положительна. Потенциальная энергия взаимодействия молекул, обусловленная силами Ван-дер-Ваальса, убывает с расстоянием в соответствии с законом
между молекулами преобладают силы отталкивания, а потенциальная энергия взаимодействия положительна. Потенциальная энергия взаимодействия молекул, обусловленная силами Ван-дер-Ваальса, убывает с расстоянием в соответствии с законом  . Так как сила Ван-дер-Ваальса может быть определена как первая производная от энергии, то
. Так как сила Ван-дер-Ваальса может быть определена как первая производная от энергии, то 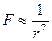 , то есть убывает с расстоянием гораздо быстрее, чем кулоновская.
, то есть убывает с расстоянием гораздо быстрее, чем кулоновская.
Силы Ван-дер-Ваальса слабее, чем при ковалентной и при ионной связи, так как они возникают при полном отсутствии обмена зарядом.
 Отклонение свойств газов от идеальности обусловлено взаимодействием Ван-дер-Ваальса и подтверждено экспериментально. При изотермическом сжатии газа, наблюдается изотерма, изображённая на рис.6.4. При сжатии газа до объёма V1 давление повышается (участок ab). При дальнейшем сжатии часть газа превращается в жидкость, но давление остаётся неизменным. На участке bc в сосуде находится жидкость и её насыщенный пар, разделённые границей, являющейся поверхностью жидкости.
Отклонение свойств газов от идеальности обусловлено взаимодействием Ван-дер-Ваальса и подтверждено экспериментально. При изотермическом сжатии газа, наблюдается изотерма, изображённая на рис.6.4. При сжатии газа до объёма V1 давление повышается (участок ab). При дальнейшем сжатии часть газа превращается в жидкость, но давление остаётся неизменным. На участке bc в сосуде находится жидкость и её насыщенный пар, разделённые границей, являющейся поверхностью жидкости.
Физически однородные части, разделённые границами, на которые распалась система, называются фазами. Таким образом, на участке bc система состоит из двух фаз – газообразной (парообразной) и жидкой. Эти фазы находятся в динамическом равновесии друг с другом. При движении от b к c возрастает доля жидкой фазы. В точке c весь сосуд заполнен жидкой фазой, произошло превращение пара в жидкость. При дальнейшем сжатии происходит воздействие на жидкость, сжимаемость которой очень мала, поэтому при небольшом уменьшении объёма давление сильно возрастает (участок cd).
 Проведение изотермического сжатия при разных температурах позволило получить семейство изотерм, изображённое на рис. 6.5. Здесь
Проведение изотермического сжатия при разных температурах позволило получить семейство изотерм, изображённое на рис. 6.5. Здесь 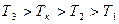 . Точка К на изотерме, соответствующей температуре Тк, называется критической точкой. По сути, это точка перегиба на критической изотерме. В критическом состоянии нет различия между жидким и газообразном состояниями, нет границы раздела между фазами. Вещество не оказывает сопротивления изменению объёма и не стремится увеличить свой объём. В среде создаются условия для больших флуктуаций плотности, благодаря чему можно наблюдать критическую опалесценцию, заключающуюся в том, что в момент исчезновения границы раздела фаз, весь объём сосуда становится непрозрачным для света и на экране появляется темнота. При температурах выше критической образование жидкости ни при каких давлениях невозможно. Критическое состояние описывают критическими параметрами состояния Т к, Р к, V к. Разные вещества имеют разные критические параметры.
. Точка К на изотерме, соответствующей температуре Тк, называется критической точкой. По сути, это точка перегиба на критической изотерме. В критическом состоянии нет различия между жидким и газообразном состояниями, нет границы раздела между фазами. Вещество не оказывает сопротивления изменению объёма и не стремится увеличить свой объём. В среде создаются условия для больших флуктуаций плотности, благодаря чему можно наблюдать критическую опалесценцию, заключающуюся в том, что в момент исчезновения границы раздела фаз, весь объём сосуда становится непрозрачным для света и на экране появляется темнота. При температурах выше критической образование жидкости ни при каких давлениях невозможно. Критическое состояние описывают критическими параметрами состояния Т к, Р к, V к. Разные вещества имеют разные критические параметры.
 2014-02-13
2014-02-13 876
876







