Внешне это проявляется в переходе твердого состояния в жидкое. После разрушения последних участков кристаллической решетки продолжающийся подвод тепла вызывает повышение температуры жидкого металла.
При охлаждении происходит обратный процесс. Горизонтальный участок кривой охлаждения показывает, что происходит кристаллизация, сопровождающаяся выделением тепла, которое называется скрытой теплотой кристаллизации. Кристаллизация металла происходит при некотором переохлаждении Δ Т, величина которого зависит от природы самого металла, от степени его загрязненности различными включениями и от скорости охлаждения. Кривые охлаждения, характеризующие процесс кристаллизации чистых металлов при охлаждении с разной скоростью, приведены на рис. 5.4.
При очень медленном охлаждении степень переохлаждения невелика и процесс кристаллизации протекает при температуре, близкой к равновесной (рис. 5.4, кривая V 1).
С увеличением скорости охлаждения степень переохлаждения возрастает (кривые V 2, V 3) и процесс кристаллизации протекает при температурах, лежащих ниже равновесной температуры кристаллизации. Чем чище жидкий металл, тем более он склонен к переохлаждению. При затвердевании очень чистых металлов степень переохлаждения Δ Т может быть очень велика.
Процесс кристаллизации начинается с образования кристаллических зародышей (центров кристаллизации) и продолжается в процессе роста их числа и размеров. Вокруг образовавшихся центров начинают расти кристаллы (рис. 5.5, а). Каждый из растущих новых кристаллов ориентирован в пространстве произвольно (рис. 5.5, б, в). При уменьшении количества жидкости поверхности растущих кристаллов соприкасаются друг с другом, их правильная внешняя форма нарушается и получается произвольной (рис. 5.5, г).
Кристаллы с неправильной внешней формой называются зернами или кристаллитами (рис. 5.5, г). Твердые тела, в том числе и металлы, состоящие из большого количества зерен, называют поликристаллическими.
Таким образом, процесс кристаллизации состоит из двух этапов:
1 ) образование центров кристаллизации (зародышей);
2) рост кристаллов вокруг этих центров.
Установлена зависимость числа центров кристаллизации (ч. ц.) и скорости роста кристаллов (с. к.) от степени переохлаждения Δ Т (рис. 5.6).
Каждый из этих параметров изменяется по закону кривых распределения, т.е. число центров кристаллизации и скорость роста кристаллов, возрастая с увеличением степени переохлаждения, имеют максимум. Размер образовавшихся кристаллов зависит от соотношения числа центров кристаллизации и скорости роста кристаллов при температуре кристаллизации, т. е. от степени переохлаждения.
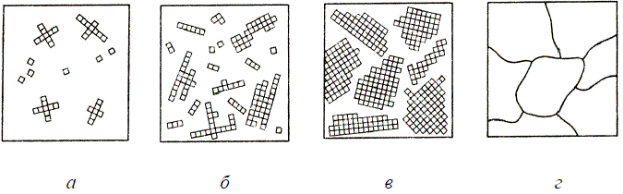
Рис. 4.5. Схемы процесса кристаллизации металла.
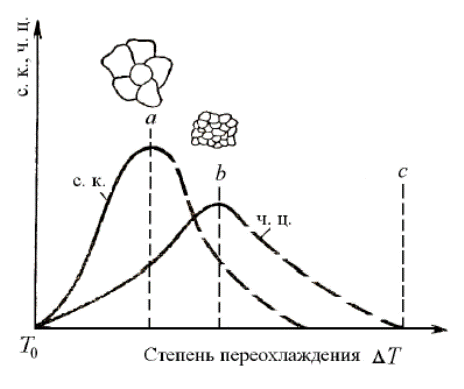
Рис. 4.6. Зависимость параметров кристаллизации от степени переохлаждения: ч. ц. – число центров кристаллизации, образующихся в единицу времени; с. к. – скорость роста кристаллов
При равновесной температуре Т 0 число центров кристаллизации и скорость роста кристаллов равны нулю, процесса кристаллизации не происходит. Если жидкость переохладить до температуры, соответствующей точке a, то образуются крупные зерна (рис. 4.6). При переохлаждении, соответствующей точке b, образуется мелкое зерно, так как в этом случае скорость роста кристаллов незначительная, а центров кристаллизации много. Если очень сильно переохладить жидкость (точка с на рис. 4.6), то число центров кристаллизации и скорость роста кристаллов становятся равными нулю, жидкость не кристаллизуется. Образуется аморфное тело.
Кроме тепловых процессов на кинетику процесса кристаллизации, на количество и размеры кристаллизующихся зерен оказывают влияние вторичные факторы. К ним относится случайное наличие в расплаве жидкости посторонних нерастворимых частиц (из шихтовых материалов) или их специальное введение (модифицирование), а также действие ультразвука или механической вибрации.
Кристаллизация без каких-либо посторонних воздействий или без наличия готовых центров кристаллизации называется самопроизвольной, при наличии готовых центров – несамопроизвольной.
Чистые металлы применяют в технике очень редко в связи с тем, что они в большинстве случаев не могут обеспечить необходимых механических и физических свойств, которые удается получить в сплавах.
Металлический сплав образуется в результате взаимодействия двух или нескольких химических элементов. Он обладает металлическими свойствами, отличающимися от свойств исходных компонентов.
Сплавы можно получить методом сплавления, порошковой металлургией, диффузией, осаждением из газовой среды различных металлов и неметаллов.
Дадим определения некоторым металлографическим понятиям.
Компонентами сплава называют химические элементы, входящие в его состав.
Однородная часть сплава, имеющая одинаковые состав, строение, агрегатное состояние, при этом отделенная от остальных частей сплава поверхностью раздела, называется фазой.
Системой называется совокупность фаз в сплаве, находящихся в состоянии стабильного или метастабильного равновесия.
Система может быть простой или сложной. Простая система состоит из одного компонента. Сложная система включает в себя два или более компонентов. Например, система Рb−Sb является двойной, система Al–Cu–Mn –тройной и т. д. Система может быть однородной (однофазной), например вода (жидкость), и неоднородной, состоящей из двух или трех фаз, например вода, лед (жидкость + твердое тело) или пар, вода, лед (жидкость + твердое тело + газ).
Фазовое состояние системы, составленной из двух компонентов, в зависимости от внешних условий может характеризоваться диаграммой состояния. Система называется равновесной, если в ней изменение фазового состояния при изменении внешних условий совершается обратимо, т. е. когда процессы при изменении состояния системы в одном направлении в точности возмещаются процессами, происходящими при изменении системы в обратном направлении.
Структурная составляющая – это однородная составляющая системы, состоящая из одной или нескольких фаз, имеющая характерное регулярное строение, форму и одинаковый средний химический состав.
Выделение из кристаллов твердой фазы других твердых фаз по мере охлаждения сплава называется вторичной кристаллизацией.
В сплаве могут образовываться следующие кристаллические фаз ы: твердые растворы и промежуточные фазы.
Твердые растворы – это кристаллы, образовавшиеся при распределении атомов одного компонента в кристаллической решетке другого. Один компонент (растворитель) сохраняет свою кристаллическую решетку, другой (растворяемый) отдает свои атомы в решетку растворител я. Вокруг атома растворенного элемента возникают местные искажения пространственной решетки, это приводит к изменению ее периода и свойств.
Твердые растворы обозначают буквами греческого алфавита α, β, γ.
Различают твердые растворы замещения и внедрения (рис. 4.7). Образование твердых растворов замещения сопровождается заменой атомов растворителя в его кристаллической решетке на атомы растворенного компонента. Это происходит, если размеры атомов обоих компонентов различаются незначительно.
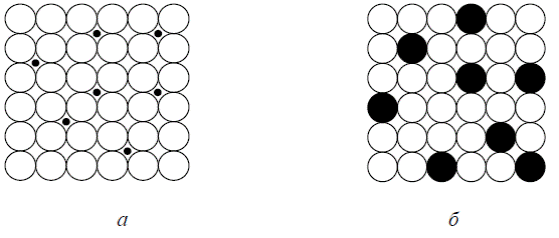
Рис. 4.7. Атомно-кристаллическая структура твердого раствора: а – внедрения; б – замещения
Твердые растворы внедрения образуются при размещении атомов растворенного компонента в порах кристаллической решетки растворителя между атомами основного метал ла. Размеры атомов растворенного компонента (азота, водорода, углерода) значительно меньше атомов растворителя.
Состав твердого раствора, т. е. количество атомов растворенного компонента и растворителя, может меняться. Максимальное число (предельная концентрация) атомов растворенного компонента, которое может находиться в решетке растворителя, определяет предельную растворимость одного компонента в другом.
Растворимость элементов, часто с понижением температуры, уменьшается при увеличении различия их атомных радиусов и их валентности. Твердые растворы внедрения имеют ограниченную растворимость (рис. 4.7, а), а твердые растворы замещения могут быть с ограниченной (рис. 4.7, б) и с неограниченной растворимостью.
Кристаллы, образованные различными элементами и имеющие собственный тип кристаллической решетки, отличающийся от решеток составляющих их элементов, называют промежуточной фазой. Свойства последней, резко отличаются от свойств исходных компонентов.
Промежуточные фазы могут иметь постоянный и переменный состав. Промежуточные фазы постоянного состава – химические соединения компонентов с кратным массовым соотношением элементов. Это позволяет выразить их состав формулой A m B n (A и B – компоненты, образующие сплав; m и n – простые числа) и постоянной температурой плавления (диссоциации).
Промежуточные фазы переменного состава, как и твердые растворы, являются кристаллами с переменной концентрацией компонентов. Переменный состав объясняется либо наличием небольших межузельных атомов в кристаллической решетке промежуточной фазы, либо недостатком атомов в узлах решетки.
Промежуточные фазы можно обозначать буквами греческого алфавита или химическими формулами, хотя промежуточные фазы переменного состава отличаются от типичных химических соединений, так как не подчиняются законам валентности. При сплавлении образуются промежуточные электронные фазы. Например, при электронной концентрации 3/2, 21/13, 7/4 фазам β, γ, ε в сплавах Cu–Zn соответствуют формулы CuZn, Cu5Zn8, CuZn3.
 2014-02-13
2014-02-13 5959
5959
