Часто в полипептидных цепях содержатся участки, последовательность аминокислотных остатков которых, образует локально упорядоченные трёхмерные структуры.
Совокупность таких упорядоченных структур называют вторичной структурой белков.
В результате совокупности действия таких факторов, как:
- плоское строение пептидной связи;
- возможность свободного вращения связей у α-углеродного атома
- постоянство углов и межатомных расстояний
формируются следующие типы вторичной структуры белков:
α-спираль, β-структура и β-складка.
2.2.1.2.1. α-спираль
Одним из основных элементов вторичной структуры белков является α ‑ спираль (Рис. 2.7):
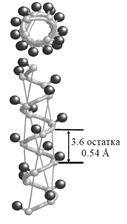
Рис. 2.7. Вторичная структура белковой молекулы: α-спираль (*)
Это — правая спираль, которую можно себе представить в виде пептидной цепи, закрученной вокруг гипотетического цилиндра. При графическом изображении спиральные участки изображаются цилиндром.
Характеристики α-спирали:
- содержит 3,6 аминокислотного остатка на виток с периодом повторяемости 5,4 нм *[0,54 Å (Å – ангстремы; 1 Å = 10 нм)];
- полипептидный остов образует плотные витки вокруг длинной оси молекулы;
- боковые радикалы выступают наружу;
- спираль удерживается водородными связями между атомом водорода N-H группы одной пептидной связи и кислородом группы С=О, принадлежащей другой пептидной связи, расположенной через четыре аминокислотных остатка над первой в следующем витке спирали;
- в α-спирали полностью использована возможность образования водородных связей (внутримолекулярные), поэтому она не способна образовывать водородные связи с другими элементами вторичной структуры.
Степень спирализации в белках колеблется от 5 до 80%. Для некоторых белков, например для цитохрома С, α-спираль лежит в основе пространственной структуры, другие, например химотрипсин, не имеют α ‑ спирализованных участков.
2.2.1.2.2. β-структура
β -структура является вторым элементом вторичной структуры белков. β- складчатые структуры – графически изображаются стрелкой (Рис. 2.8):
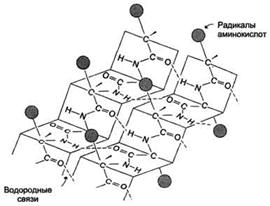
Рис. 2.8. Вторичная структура белковой молекулы: β-структура. Лист
β-структуры имеет складчатую поверхность. Водородные связи между β-тяжами изображены пунктиром
Характеристика β-структуры:
- остов полипептидной цепи в β-структуре вытянут таким образом, что имеет уже не спиральную, а зигзагообразную складчатую форму;
- боковые группы аминокислотных остатков (R-группы) направлены перпендикулярно плоскости складчатого слоя и расположены выше и ниже него;
- в отличие от α-спирали β-структура образована за счет межцепочечных водородных связей между соседними участками полипептидной цепи, так как внутрицепочечные контакты отсутствуют.
- в отличие от α-спирали, насыщенной водородными связями, каждый участок полипептидной цепи в β-структуре открыт для образования дополнительных водородных связей.
Соотношение между различными типами вторичных структур в составе белков варьирует в широких приделах, причём доля неупорядоченных структур часто превалирует над регулярными – α-спиралью и
β-структурой.
2.2.1.2.3. β-изгиб
В области неупорядоченных структур достаточно протяжённые зоны представлены петлями и резкими изгибами.
Наиболее часто встречаются так называемые β-изгибы, когда полипептидная цепь резко меняет своё направление на 180º. Этот изгиб по форме напоминает шпильку для воло с и образуется между тремя аминокислотами за счет водородной связи (см. презентацию к лекции). Он необходим для изменения пространственного расположения полипептидной цепи при образовании третичной структуры белка.
!!! Какую именно конформацию принимают участки полипептидной цепи (α-спираль, β‑складку, β-изгиб или остаются неструктурированными) в значительной степени определяется первичной последовательностью полипептидной цепи.
 2015-01-21
2015-01-21 2947
2947
