Третичная структура белков – это трёхмерная структура полипептидной цепи, которая определяется первичной и вторичной структурой и характеризуется наличием биологической активности.
Это объясняется тем, что в результате взаимодействий аминокислотных остатков полипептидной цепи уменьшается свободное вращение связей полипептидного остова.
Ограничение подвижности и тем самым формирование и поддержание третичной структуры возникает также за счёт общего вклада слабых нековалентных взаимодействий (Рис. 2.9):
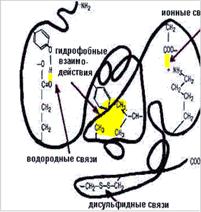
Рис. 2.9. Связи, стабилизирующие третичную структуру белковой молекулы:
1 - электростатические силы притяжения между R-группами, несущими противоположно заряженные ионогенные группы (ионные связи); 2 - водородные связи между полярными (гидрофильными) R-группами; 3 - гидрофобные взаимодействия между неполярными (гидрофобными) R-группами;
4 - дисульфидные связи между радикалами двух молекул цистеина.
Рассмотрим особенности строения третичной структуры белковой молекулы на примере одного из самых простых белков – инсулина. Первичная последовательность инсулина приведена на рисунке 2.10, а третичная структура - на рисунке 2.11:

Рис. 2.10. Первичная последовательность гормона инсулина. Показаны
S–S-мостики и участки первичной последовательности, образующие вторичные структуры
Гормон состоит из двух пептидных цепей — короткой (21 аминокислотный остаток) и длинной (30 аминокислотных остатка).
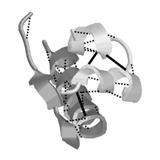
Рис. 2.10. Третичная структура инсулина. Здесь спиралями представлены
a -спиральные участки, стрелками - b -складки и цилиндрическими кривыми - нерегулярные участки. Пунктиром показаны водородные связи, а сплошными линиями - S–S‑мостики.
На рисунке хорошо видно, что три S–S-мостика играют ключевую роль в организации третичной структуры:
- один из них взаимно ориентирует две α-спирали короткой последовательности;
- два других скрепляют короткую и длинную цепи;
- третичная последовательность буквально пронизана водородными связями;
- третичная структура инсулина состоит в основном из α-спиралей.
Третичная структура белковой молекулы возникает самопроизвольно. Движущей силой, свёртывающей полипетидную цепь белка в строгое трёхмерное образование, является взаимодействие аминокислотных радикалов с молекулами воды.
При этом гидрофобные радикалы втягиваются внутрь белковой молекулы, образуя там гидрофобную зону (гидрофобный карман), а гидрофильные радикалы ориентируются в сторону растворителя – воды.
 2015-01-21
2015-01-21 1123
1123
