Различают несколько уровней структуры белков: первичную, вторичную, третичную, а для олигомерных белков — и четвертичную структуры.
Первичная структура
Первичная структура — это последовательность аминокислотных остатков, связанных друг с другом пептидными связями (сл. 21).
Именно данная структура непосредственно кодируется последовательностью кодонов в мРНК и воспроизводится при трансляции.
Принципиально важно, что практически все 20 аминокислотных остатков, встречающихся в природных белках, имеют сходный план строения. Они содержат трехчленный остов, со средним (α-углеродным) атомом которого связан тот или иной радикал R:
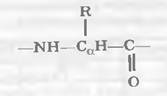
Именно радикалами и различаются аминокислотные остатки. Соединяясь друг с другом пептидными связями, остовы остатков формируют непрерывный остов пептидной цепи, где чередуются три типа связи (сл. 22). Вокруг одной из них (пептидной связи -СО—NH-) вращения невозможны. Зато вокруг двух остальных связей (-NH—СαН- и -СαН—СО-) возможно вращение. Это-то и позволяет пептидной цепи изгибаться самым причудливым образом, что приводит к образованию вторичной и третичной структур.
Вторичная структура
Вначале многие фрагменты пептидной цепи приобретают периодическую укладку того или иного типа: α-спираль или β-структуру. Этот низший уровень пространственной организации называется вторичной структурой.
Так, целиком представлены α-спиралью следующие белки: миозин, тропомиозин α- кератин. В этих белках несколько цепей с α-спиралей закручены в суперспираль.
Белки же только с β-структурой – фиброин шелка и β-кератин.
Особый вид вторичной структуры в еще одном фибриллярном белке – коллагене. Он имеет общие черты и с α- спиралью, и с β- структурой и называется коллагеновой спиралью.
Что же представляют собой α-спираль и β-структура?
а) α-Спиралъ (сл.23). Здесь остов пептидной цепи закручивается в спираль так, что радикалы аминокислот обращены кнаружи от спирали.
Эта структура удерживается водородными связями между остовами аминокислот. Более точно, в образовании одной такой связи участвуют группа –NН– одной аминокислоты и группa –СО– другой аминокислоты, которая в пептидной цепи отделена от первой тремя другими аминокислотами.
В итоге на один виток α- спирали приходится в среднем 3,6 аминокислотных остатков.
Важно подчеркнуть, что α- спираль (как в других случаях β-структуpa) образуется только потому, что является наиболее термодинамически выгодным состоянием для данного участка пептидной цепи.
6) β-Структура (сл.24). Здесь остовы пептидных цепей не скручены в спираль, а имеют зигзагообразную конфигурацию (структура складчатого листа)
Такая структура тоже удерживается водородными связями и между теми же группами (–NН– и –СО—). Но теперь для сближения этих групп и образования связей пептидная цепь образует складки.
От чего же зависит вторичная структура того или иного белка или его фрагмента? Ответ однозначен: она определяется первичной структурой белка или рассматриваемого фрагмента.
Иными словами, боковые радикалы аминокислот, хотя непосредственно и не участвуют в стабилизирующих эту структуру связях, тем не менее определяют, каким образом пептидная цепь может свернуться для образования таких связей и может ли свернуться вообще.
Третичная структура
О третичной структуре обычно говорят применительно лишь к глобулярным белкам.
Под ней понимают конформацию белковой глобулы, т. е. укладку в пространстве α-спи ральных, β -структурных и бесструктурных участков пептидной цепи.
В отличие от вторичной, третичная структура образуется иудерживается за счет образования связей непосредственно между радикалами аминокислот.
Конкретный характер этих связей зависит от природы радикалов.
По своим физико-химическим свойствам радикалы всех аминокислот подразделяются на 3 группы, а образуемые между ними связи сводятся к 4-5 видам.
Одна связь является ковалентной — дисульфидная связь между остатками цистеина.
Остальные связи — нековалентные, т. е. относятся к т. н. слабым взаимодействиям. Это:
- ионные связи между разноименно заряженными (а,следовательно, гидрофильными) радикалами.
- водородные связи между полярными (как заряженными, так и незаряженными) радикалами,
- гидрофобные и ван-дер-ваальсовы взаимодействия между неполярными (т. е. гидрофобными) радикалами (сл.25, 26).
Замыкание большого числа межрадикальных связей приводит к образованию термодинамически наиболее устойчивой конфигурации — нативной третичной структуры белка.
При этом взаимодействующие друг с другом радикалы могут находиться в вытянутой пептидной цепи весьма далеко друг от друга. Сближение же их происходит лишь в результате сложных изгибов этой цепи в трехмерном пространстве.
В итоге образуется глобулярная частица, причем одни радикалы находятся внутри нее, а другие — ив ее поверхности.
Вообще, формирование третичной структуры играет решающую роль в приобретении белком присущей ему функциональной активности.
Как правило, именно на уровне этой структуры в белке появляются т. н. активные центры (один или несколько), группы из нескольких радикалов, способные специфично взаимодействовать с определенными лигандами.
Эти радикалы опять-таки на уровне первичной структуры зачастую находятся далеко друг от друга и сближаются лишь в процессе фолдинга.
Вместе с тем третичная структура обладает определенной подвижностью. Изменение конформации белков — важнейший способ изменения их биологической активности, который широко используется в клетке для peгуляции различных процессов.
Четвертичная структура
О наличии у белка четвертичной структуры говорят тогда, когда он состоит из нескольких субъединиц. Примером является гемоглобин, молекула которого включает 4 субъединицы двух видов.
Субъединицы связываются за счет взаимодействия аминокислотных радикалов, находящихся на контактирующих поверхностях субъединиц.Связывание субъединиц может происходить лишь после образования третичной структуры.
С другой стороны, это связывание само сказывается на третичной структуре субъединиц: доводит ее до функционально активного или, напротив, неактивного состояния. Поэтому такие белки обычно активны лишь в олигомерной форме (как гемоглобин) или, наоборот, только в диссоциированном состоянии (как некоторые протеинкиназы).
Формирование нативной трехмерной структуры белков.
(Факторы, определяющие пространственную структуру белка)
Роль первичной структуры
Первичная структура белка полностью определяет вторичную структуру различных его фрагментов. То же самое можно сказать и в отношении более высоких структур — третичной и четвертичной.
Это было показано К. Анфинсеном в 1973 г. в классическом эксперименте с рибонуклеазой (рис. 3.19).
Данная РНКаза состоит из одной пептидной цепи, включающей 124 аминокислотных остатка. Среди них — 8 остатков цистеина (Цис), образующих попарно 4 дисульфидные связи.
Принципиальный момент: всего может быть 105 комбинаций таких попарных взаимодействий; в каждой из них n = 8 остатков Цис образуют друг с другом 4 дисульфидные связи. (Согласно комбинаторике, количество этих комбинаций рассчитывается как произведение нечетных чисел до n: в данном случае — 3x5x7 = 105.)
Из всех комбинаций в нативной РНКазе реализуется только одна — и строго определенная: 26-84, 40-95, 58- 110, 65- 72 (цифры указывают положение остатков Цис в вытянутой полипептидной цепи). Как видно, в большинстве случаев взаимодействующие радикалы Цис находятся в пептидной цепи достаточно далеко друг от друга.
Кроме дисульфидных, в третичной структуре РНКазы имеются и другие связи— в частности, водородные.
Таким образом, вся информация о третичной структуре белка заключена в его первичной структуре, т.е. в последовательности аминокислот в пептидной цепи.
Однако, хотя первичная структура пептидной цепи, конечно, играет определенную роль в фолдинге этой цепи, но она не всегда оказывается достаточной для обеспечения фолдинга или (и) его окончательного завершения.
 2014-02-09
2014-02-09 1853
1853








