Тепловой эффект химической реакции (ТЭХР) рассматривается только для закрытых ТС 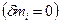 при отсутствии работ
при отсутствии работ 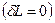 и при фиксации двух параметров: T,V =const и T,p =const. При этих условиях мы фактически задаем состояние ТС, если система является равновесной.
и при фиксации двух параметров: T,V =const и T,p =const. При этих условиях мы фактически задаем состояние ТС, если система является равновесной.
Для простой, закрытой ТС уравнение 1-го закона термодинамики имеет вид:
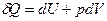 , при Т,V =const:
, при Т,V =const:  , (1)
, (1)
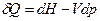 , при Т,р =const:
, при Т,р =const:  . (2)
. (2)
Тепловой эффект ХР – это максимальная теплота процесса, выделяемая или поглощаемая ТС при T,V =const и Т,р =const и отнесенная к пробегу ХР, т.е.:
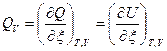 , [Дж/моль], (3)
, [Дж/моль], (3)
 , [Дж/моль], (4)
, [Дж/моль], (4)
где QV – изохорный тепловой эффект ХР; Qp - изобарный тепловой эффект ХР; 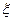 - пробег ХР. QV и Qp – функции состояния, т.е. они характеризуют термодинамическое состояние химически реагирующей ТС.
- пробег ХР. QV и Qp – функции состояния, т.е. они характеризуют термодинамическое состояние химически реагирующей ТС.
Таким образом, изохорный QV и изобарный Qp ТЭХР выражаются через изменение внутренней энергии и энтальпии соответственно и определяются только начальными и конечными состояниями ТС.
Тепловые эффекты ХР не зависят от промежуточных химических состояний, через которые проходит ТС (закон Гесса, 1840г.).
В соответствии с законом Гесса сумма тепловых эффектов промежуточных ХР есть величина постоянная, равная тепловому эффекту сложной реакции независимо от последовательности протекания реакций. Закон Гесса позволяет косвенным путем аналитически вычислить тепловые эффекты ХР, в том числе и таких, которые не поддаются эксперименту.
Для ТС, где протекает одна химическая реакция, внутренняя энергия и энтальпия определяются выражениями:
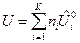 , (5)
, (5)
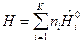 , (6)
, (6)
где 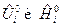 , Дж/моль, молярные величины внутренней энергии и энтальпии i-го вещества при стандартном состоянии (р 0=1 физ.атм);
, Дж/моль, молярные величины внутренней энергии и энтальпии i-го вещества при стандартном состоянии (р 0=1 физ.атм); 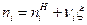 , моль, количество i-го вещества.
, моль, количество i-го вещества.
Соотношения (5) и (6) справедливы как для идеальных, так и для реальных газов и растворов. Для идеальных термодинамических систем величины 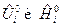 являются функциями только температуры. Тогда получим связи:
являются функциями только температуры. Тогда получим связи:
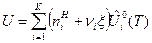 , (7)
, (7)
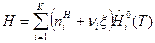 . (8)
. (8)
После подстановки выражений (7) и (8) в формулы (3) и (4) и дифференцирования по пробегу ХР 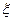 получим формулы для расчета изохорного и изобарного ТЭХР:
получим формулы для расчета изохорного и изобарного ТЭХР:
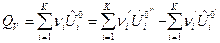 , Дж/моль, (9)
, Дж/моль, (9)
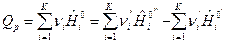 , Дж/моль (10)
, Дж/моль (10)
По формулам (9) и (10) определяется тепловой эффект образования вещества. Тепловой эффект сгорания (теплота сгорания) равен теплоте образования с обратным знаком:
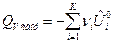 , (11)
, (11)
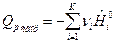 . (12)
. (12)
Рассмотрим пример: для ХР: 2Н2О-2Н2-О2=0. Изобарный ТЭХР равен:  , Дж/моль, т.е. из двух молекул Н2 и одной молекулы О2 образуется две молекулы воды. Если число элементарных реакций равно NA=6,022·1023, то суммарная теплота этих реакций является тепловым эффектом. Таким образом, моль – это набор из пяти частиц (2Н2, О2, 2Н2О) умноженный на число Авагадро.
, Дж/моль, т.е. из двух молекул Н2 и одной молекулы О2 образуется две молекулы воды. Если число элементарных реакций равно NA=6,022·1023, то суммарная теплота этих реакций является тепловым эффектом. Таким образом, моль – это набор из пяти частиц (2Н2, О2, 2Н2О) умноженный на число Авагадро.
Если 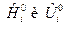 зависят и от температуры и от состава ТС, то получим выражения:
зависят и от температуры и от состава ТС, то получим выражения:
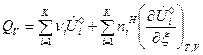 , (13)
, (13)
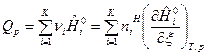 . (14)
. (14)
Связь между изобарным и изохорным ТЭХР получим следующим образом. Запишем для 1 моля идеального газа выражение для энтальпии:
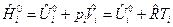 .
.
Тогда для смеси идеальных газов имеем:
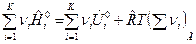 , (15)
, (15)
где 
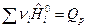 ;
; 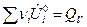 .
.
После подстановки Qp и QV в выражение (15) имеем:
 . (16)
. (16)
Эта связь между Qp и QV для смеси идеальныхгазов получена, пренебрегая объемами жидких и твердых реагентов.
Зависимость 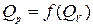 определяется видом ХР:
определяется видом ХР:
- если 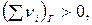 то Qp > QV
то Qp > QV
- если 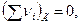 то Qp = QV
то Qp = QV
- если 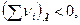 то Qp < QV.
то Qp < QV.
Для конденсированных веществ (растворов) 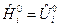 .
.
 2015-01-21
2015-01-21 3933
3933
