Приведенная энергия Гиббса для 1 моля вещества при стандартном состоянии  вводится следующим соотношением:
вводится следующим соотношением:
 [Дж/моль×К] (1)
[Дж/моль×К] (1)
где  - мольная свободная энергия Гиббса при стандартном давлении, Дж/моль;
- мольная свободная энергия Гиббса при стандартном давлении, Дж/моль; 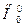 - энтальпия образования вещества при Т =0 К из простых химических элементов:
- энтальпия образования вещества при Т =0 К из простых химических элементов: 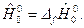
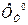 является функцией состояния и зависит только от температуры.
является функцией состояния и зависит только от температуры.
Возьмем производную от ( ) по температуре при p =const:
) по температуре при p =const:
 (2)
(2)
В уравнении (2) производная от энергии Гиббса по температуре равна
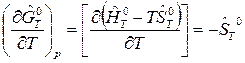 , (3)
, (3)
а величина  по определению равна
по определению равна
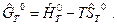 (4)
(4)
Подставляя (3) и (4) в (2) получим
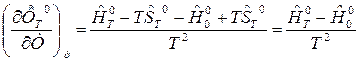 (5)
(5)
или
 (6)
(6)
Первая производная от приведенной энергии Гиббса по температуре дает избыточную энтальпию. Для практических задач гораздо удобнее брать производную по логарифму температуры, учитывая, что dT = Td ln T. Тогда имеем
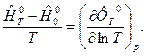 (7)
(7)
Запишем выражение (6) в виде 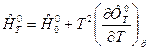 (8)
(8)
Вторая производная от  по температуре при р =const дает теплоемкость
по температуре при р =const дает теплоемкость
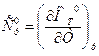 =
=  (9)
(9)
или  (10)
(10)
Зависимости (6), (7), (9) и (10) для ( )/ Т и
)/ Т и 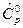 используются для получения аппроксимаций по температуре термодинамических свойств индивидуальных веществ. Молярная энтропия при стандартном давлении также выражается через приведенную энергию Гиббса:
используются для получения аппроксимаций по температуре термодинамических свойств индивидуальных веществ. Молярная энтропия при стандартном давлении также выражается через приведенную энергию Гиббса:
|
|
|
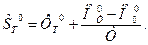 (11)
(11)
 2015-01-21
2015-01-21 4648
4648
