При расчете молярной свободной энергии Гиббса для реальных газов и растворов, можно использовать формулы, полученные для идеальных газов и растворов. При этом парциальные давления pi заменяются на величину летучести fi [Па], а молярные доли xi – на активности ai. Летучесть – это давление, определенное по уравнению состояния для реальных газов, оказывающее такое же действие на систему, как и в случае идеального газа. Фактически fi - это исправленное давление, которое характеризует отклонение термодинамической системы от идеального состояния, описываемого уравнением состояния для идеального газа.
Таким образом, для реальных газов величина молярной свободной энергии Гиббса будет определяться выражением
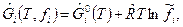
где 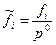 ,
, 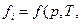 состава). С приближением состояния реального газа к состоянию идеального газа летучесть
состава). С приближением состояния реального газа к состоянию идеального газа летучесть 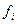 стремится к парциальному давлению
стремится к парциальному давлению 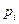 . Для идеального газа fi=pi (при малых давлениях).
. Для идеального газа fi=pi (при малых давлениях).
Активность ai (величина безразмерная) представляет собой исправленную молярную долю xi, которая характеризует отклонение конденсированной системы от идеального состояния. С приближением реального раствора к идеальному состоянию активность ai стремится к молярной доле xi. Для слабых растворов ai = xi. Таким образом, для реальных растворов
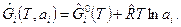
Описанный метод расчета свободной энергии Гиббса был предложен американским физико-химиком Льюисом Г.Н. (1875-1946).
В термодинамике используются также понятия коэффициентов летучести 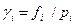 и активности
и активности 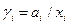 . Для идеальных газов и растворов
. Для идеальных газов и растворов 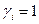 .
.
 2015-01-21
2015-01-21 648
648








