Количественное соотношение между веществами в момент равновесия ТС носит название закона действующих масс. Рассмотрим термодинамическую систему, в которой происходит одна химическая реакция. В состоянии равновесия системы химическое сродство
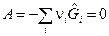 , (1)
, (1)
где 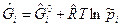 - для газообразных веществ;
- для газообразных веществ; 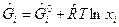 - для конденсированных веществ.
- для конденсированных веществ.
а). Для газообразных веществ при А=0 имеем:
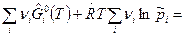 0
0
или
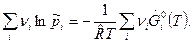 (2)
(2)
Правая часть этого уравнения является функцией только температуры. Введем обозначение
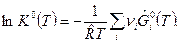 (3)
(3)
При T=const К0 - величина постоянная и называетсяконстантой равновесия химической реакции. К0 - величина безразмерная. Константа равновесия ХР связывает между собой парциальные давления веществ в реагирующей системе. К0(Т) – параметр состояния, зависящий только от температуры и равный:
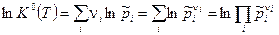 , (4)
, (4)
где 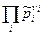 - произведение величин
- произведение величин 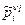 .
.
Тогда получим закон действующих масс в виде:
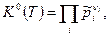 (5)
(5)
или
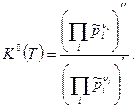 (6)
(6)
Здесь числитель относится к правой части уравнения химической реакции, знаменатель – к левой. Например, для реакции 2Н2 +О2=2Н2О 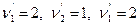 закон действующих масс имеет вид
закон действующих масс имеет вид
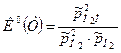 , где
, где 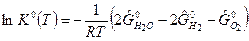 .
.
б). Если все реагенты являются конденсированными веществами, то закон действующих масс имеет вид:
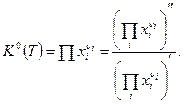 (7)
(7)
Константа равновесия ХР К0 в этом случае вводится также с помощью выражения (3).
в). В общем случае, когда реагенты находятся и в газообразной и в конденсированной фазах химическое сродство в состоянии равновесия ХР равно: 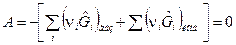 . Тогда закон действующих масс примет вид:
. Тогда закон действующих масс примет вид:
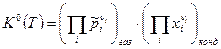 , (8)
, (8)
или 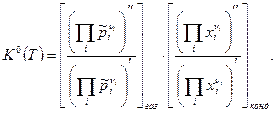 (9)
(9)
Рассмотрим пример: 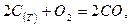
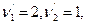
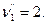 Тогда
Тогда 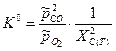 , где
, где 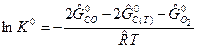 .
.
Если реагент С (Т) находится в чистой фазе, то хс =1.
10.4. Константы равновесия Кр, Кх, Кс и связь между ними
Закон действующих масс может быть выражен через константы равновесия Кc, Кр и Кх которые связаны между собой.
а) Если все реагенты ХР- газообразные вещества, то закон действующих масс имеет вид
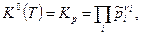 (10)
(10)
где 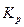 - константа равновесия, выраженная через парциальные давления.
- константа равновесия, выраженная через парциальные давления.
Выразим 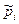 через молярные доли xi:
через молярные доли xi: 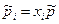 и подставим в (10):
и подставим в (10):
Тогда получим:
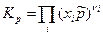
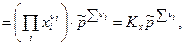 (11)
(11)
где 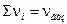 - стехиометрические коэффициенты только газообразных веществ; Кх – константа равновесия, выраженная через молярные доли:
- стехиометрические коэффициенты только газообразных веществ; Кх – константа равновесия, выраженная через молярные доли:
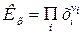 , (12)
, (12)
где 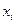 - молярные доли всех участников реакции.
- молярные доли всех участников реакции.
Связь Кх с Кр будет иметь вид:
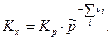 (13)
(13)
б) Выразим 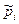 через молярные концентрации
через молярные концентрации 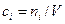 , моль/м3 и запишем уравнение состояния для i -го компонента смеси идеальных газов в виде:
, моль/м3 и запишем уравнение состояния для i -го компонента смеси идеальных газов в виде: 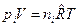 . Тогда получим
. Тогда получим 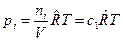 , или после деления на величину давления в одну физическую атмосферу:
, или после деления на величину давления в одну физическую атмосферу:
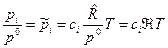 , (14)
, (14)
где 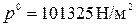 ;
; 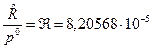 , [м3/моль×К].
, [м3/моль×К].
После подстановки 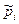 (выражение (14)) в (10) имеем:
(выражение (14)) в (10) имеем:
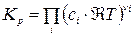 =
= 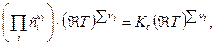 (15)
(15)
где Кс - константа равновесия, выраженная через молярные концентрации сi, равна:
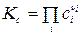 . (16)
. (16)
Тогда связь Кс с Кр будут иметь вид:
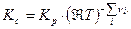 (17)
(17)
Таким образом связь между Кр, Кх и Кс имеет вид
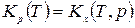
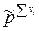 =
= 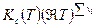 .
.
Из приведенных соотношений следует, что если все реагенты ХР – газообразные, то К 0 =Кр, а если все реагенты ХР – конденсированные, то К 0 =КХ. В общем виде закон действующих масс (8) можно представить в виде:
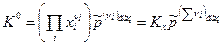 . (18)
. (18)
где 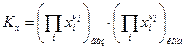 .
.
Для многофазных реагирующих систем удобно использовать для задания состава молярные доли хi и выражать закон действующих масс через константу Кх. Если все реагенты ХР конденсированные вещества, то в этом случае константу равновесия, выраженную через молярные концентрации Кс, использовать нельзя.
 2015-01-21
2015-01-21 3427
3427