Исходные данные:
Высота полета y=5км; давление в камере сгорания 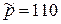 ; горючее – метан СН4; окислитель – смесь дикислорода
; горючее – метан СН4; окислитель – смесь дикислорода 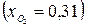 и диазота
и диазота 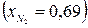 ; коэффициент избытка окислителя
; коэффициент избытка окислителя 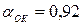 , секундный расход топлива
, секундный расход топлива 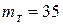 кг/с.
кг/с.
Уравнение химической реакции
CH4+2O2=CO2+2H2O
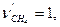
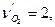
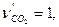
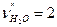 ,
,
или CO2+2H2O-CH4-2O2-ON2=0,
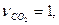
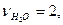
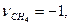
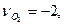
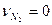 ,
,
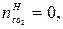
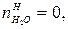
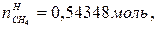
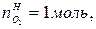
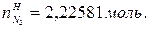
В этом случае 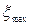 =0,5моль,
=0,5моль, 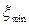 =0.
=0.
Результаты расчета ЖРД с учетом одной химической реакции представлены в следующей таблице.
| обозначения | ед. измерения | сечение 2-2 | сечение 3-3 | сечение 4-4 |
| T | K | 298,15 | 2921,36 | |
| p | Пa | 54048,3 | ||
| V | м3 | 0,0008383 | 0,0082108 | 0,6018740 |
n 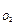 | моль | 0,0000001 | 0,0000001 | |
n 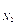 | моль | 2,225806 | 2,225806 | 2,225806 |
n 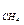 | моль | 0,543478 | 0,043478 | 0,43478 |
n 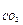 | моль | 0,49999995 | 0,49999995 | |
n 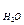 | моль | 0,9999999 | 0,9999999 | |
| n | моль | 3,769284 | 3,769284 | 3,769284 |
m 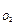 | кг | 0,032 | 0,00000000032 | 0,00000000032 |
m 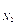 | кг | 0,062323 | 0,062323 | 0,062323 |
m 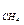 | кг | 0,0086944 | 0,0006956 | 0,0006956 |
m 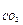 | кг | 0,021999997 | 0,021999997 | |
m 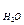 | кг | 0,017999998 | 0,017999998 | |
| m | кг | 0,103017 | 0,103017 | 0,103017 |
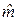 | кг/моль | 0,02733 | 0,02733 | 0,02733 |
| r | кг/м3 | 122,8880 | 12,5465 | 0,17116 |
| R’ | Дж/(кг×K) | 304,272 | 304,272 | 304,272 |
| H | Дж | -2790,7 | -2790,7 | -306278,7 |
| S | Дж/K | 614,728 | 941,942 | 941,942 |
| Cp | Дж/K | 113,602 | 175,173 | 145,895 |
| Cv | Дж/K | 82,263 | 143,834 | 114,556 |
| к | - | 1,381 | 1,218 | 1,274 |
| a | м/c | 353,949 | 1040,278 | 634,148 |
| Wc | м/c | - | - | 2427,330 |
| Mc | - | - | - | 3,828 |
| P | Н | - | - | 84956,554 |
Изложенный метод термодинамического расчета позволяет наряду с расчетом реального процесса сгорания в ЖРД использовать модели смесей идеальных газов для характерных точек цикла для простой, закрытой термодинамической системы, а использование таблиц индивидуальных веществ позволяет учесть зависимость термодинамических свойств реагентов от температуры, что увеличивает точность термодинамических расчетов ракетных двигателей.
 2015-01-21
2015-01-21 823
823








