В общем случае электрохимический преобразователь состоит из заполненной электролитом ячейки и электродной системы из двух или нескольких электродов, включаемых в измерительную цепь.
Как элемент электрической цепи электролитическая ячейка может характеризоваться развиваемой ею ЭДС, падением напряжения от проходящего тока, электрическим зарядом, сопротивлением, емкостью и индуктивностью. Выделяя зависимость между одним из этих электрических параметров и измеряемой величиной и подавляя действие других факторов, можно создать электрохимические преобразователи для измерения состава и концентрации веществ, количества электричества, времени, давления, перемещения, скорости, ускорения и ряда других физических величин.
Электрические параметры ячейки зависят от природы и состава электролита и электродов, химических превращений в ячейке, температуры, скорости перемещения раствора и других величин. Связи между этими величинами и электрическими параметрами электрохимических преобразователей определяются законами электрохимии [1].
Диссоциация. При растворении солей, кислот и оснований в воде и ряде других растворителей (спирт, этиленгликоль, диметилформамид и др.) происходит диссоциация–расщепление молекул на положительные ионы (катионы) и отрицательные ионы (анионы). Такие электропроводящие растворы называются электролитами, или проводниками второго рода. К электролитам относятся также многие твердые вещества и расплавленные соли. Разработаны твердые электролиты (иодид серебра – рубидий, бета-глиноземы и др.), обладающие большой проводимостью при температурах от –55 до +75 °С.
Перемещение ионов может происходить за счет диффузии, обусловленной различной концентрацией ионов в отдельных частях электролита, конвекции – переноса ионов вместе с потоком движущейся жидкости и миграции (электропроводности) – движения заряженных частиц под действием электрического поля.
Миграционный ток подчиняется закону Ома:
J = g Е,
где J – плотность тока; Е – напряженность электрического поля; g– электрическая проводимость.
Зависимость проводимости электролитов от концентрации. Проводимость чистой, тщательно дистиллированной воды близка к нулю и возрастает по мере повышения концентрации растворенных в ней веществ.
Растворы характеризуются весовой концентрацией р, измеряемой в граммах на литр, эквивалентной или молярной концентрацией с, измеряемой в грамм-эквивалентах (г-экв) или грамм-молекулах (г-моль) на литр, и химической активностью а.
Раствор с эквивалентной концентрацией 1 г-экв растворенного вещества на 1 л раствора называется нормальным (н) раствором.
Химическая активность а равна произведению эквивалентной концентрации c на коэффициент активности f, равный единице для растворов бесконечного разбавления и уменьшающийся по мере повышения концентрации, так как химическая активность растворенного вещества падает с ростом концентрации из-за уменьшения степени диссоциации и подвижности ионов.
Удельная проводимость раствора пропорциональна его химической активности:
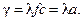
Коэффициент l называется эквивалентной электропроводимостью. Удельная проводимость зависит от концентрации нелинейно.
Зависимость проводимости электролитов от значения химической активности а, не имеющего в общем случае однозначной связи с концентрацией, позволяет создавать измерительные преобразователи для контроля параметров реальных химико-технологических процессов, так как они наиболее точно характеризуются именно значением химической активности а.
Зависимость проводимости электролитов от температуры. Подвижность ионов сильно зависит от температуры раствора, и поэтому с увеличением температуры проводимость возрастает. Температурная зависимость проводимости водных растворов при небольших концентрациях (до 0,05 н) можно определить как
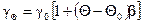 ,
,
где b – температурный коэффициент проводимости.
Примерные значения b равны: 0,016 К-1 для кислот, 0,019 К-1 для оснований и 0,024 К-1 для солей.
Электролиз, поляризация и потенциалы выделения. Прохождение электрического тока через электролиты сопровождается электролизом –химическими превращениями и выделением вещества из раствора. Для электрохимического превращения 1 г-экв любого вещества необходимо одно и то же количество электричества, равное произведению числа Авогадро N на заряд электрона и называемое постоянной Фарадея F = Ne = 96 552 Кл/г-экв [1].
Таким образом, прохождение через электролит любого сколь угодно малого количества электричества всегда сопровождается выделением на одном электроде и растворением на другом соответствующего, совершенно определенного количества вещества. В результате этого концентрация ионов вблизи электродов оказывается не такой, как в остальном растворе.
Явление поляризации заключается в изменении электродных потенциалов вследствие изменения приэлектродной концентрации при протекании через электролитическую ячейку электрического тока от внешнего источника. Вследствие этого внешнее напряжение, приложенное к электролитической ячейке, должно уравновешивать не только падение напряжения на столбе электролита, но еще и сумму потенциалов поляризации электродов.
Зависимость суммарного напряжения поляризации D U от изменения плотности тока на электродах различна для разных сочетаний растворов и электродов. Общий характер этих зависимостей заключается в том, что напряжение поляризации D U быстро возрастает при очень малых плотностях тока, а затем остается почти постоянным, слабо изменяясь с дальнейшим ростом плотности тока. Поэтому в первом приближении при достаточно большой плотности тока значение D U можно считать не зависящим от плотности тока, а только от сочетания материалов электрода и электролита.
Вследствие конечной скорости диффузии при данной концентрации электролита к катоду в единицу времени может подходить только конечное число носителей заряда – ионов вещества. Поэтому, если пытаться беспредельно увеличивать электрический ток через ячейку, то при каком-то токе будут использованы все ионы, приносимые к катоду диффузией, и дальнейший рост тока прекратится. Предельный ток диффузии можно определить из приближенного выражения:
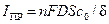 ,
,
где D – коэффициент диффузии; c0 – концентрация реагирующих ионов в толще электролита; S – площадь электрода; d – толщина диффузионного слоя.
Потенциал, при котором в процесс электролиза вступает основная масса ионов данного вида, называется потенциалом выделения данного иона. Если в растворе содержатся разные виды ионов, то зависимость I = f (U) имеет форму ступенчатой кривой. Потенциал выделения, при котором начинается очередной рост тока, зависит от вида иона, а высота ступеней тока пропорциональна концентрации этих ионов. На использовании этого явления основан полярографический метод качественного и количественного анализа растворов [1].
Проводимость электролитов для переменного тока. Явление поляризации затрудняет измерение сопротивления электролитов, так как падение напряжения на электролитической ячейке складывается из падения напряжения на столбе электролита и потенциалов поляризации электродов, которые могут достигать 1,5–2 В. При измерении сопротивления электролита постоянному току явление поляризации может обусловить значительную погрешность, поэтому такие измерения обычно производят на переменном токе.
При прохождении через ячейку переменного синусоидального тока изменение концентрации ионов в приэлектродном слое относительно средней концентрации будет происходить также по синусоидальному закону. Однако в течение всего положительного полупериода электрод (являющийся в это время анодом) будет непрерывно отдавать в раствор катионы и их концентрация у электрода будет повышаться. Максимум концентрации, а следовательно, и максимум напряжения поляризации будут достигнуты только в конце полупериода, т.е. тогда, когда ток упадет до нуля.
В течение отрицательного полупериода электрод, являясь катодом, наоборот, будет непрерывно забирать катионы из раствора, их концентрация и напряжение поляризации будут непрерывно понижаться и достигнут минимума только в конце полупериода, когда ток вновь будет проходить через нуль.
Таким образом, отличие явления поляризации при переменном токе заключается в том, что напряжение поляризации в этом случае является также переменным и отстает по фазе от тока на 90°. Падение напряжения на столбе электролита по фазе совпадает с током. В широком диапазоне изменения токов напряжение D U примерно остается постоянным и равным 0,1–1,5 В в зависимости от сочетания материалов электродов и электролита.
Емкость в эквивалентной схеме определяется из соотношения
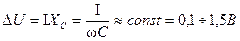
и равна
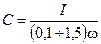 .
.
Каждому значению тока и частоты соответствует свое значение емкости С. Вследствие малого падения напряжения D U при значительных токах емкость С достигает больших значений (до 0,1—0,5Ф на 1 м2 поверхности электродов).
Кроме емкостей C 1 и С 2, иногда необходимо учитывать и емкость С 3, обусловленную размерами электролитической ячейки как конденсатора и диэлектрической постоянной раствора. Значения С 3обычно лежат в пределах 10-10–10-12 Ф.
Преимущество измерения сопротивления электролитической ячейки переменному току заключается в том, что благодаря 90-градусному углу сдвига между падением напряжения на столбе электролита и напряжением поляризации эти напряжения суммируются не арифметически (как при постоянном токе), а геометрически.
При D U£ U погрешность равна:
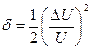
и может быть в значительной степени устранена при применении фазочувствительных указателей, в то время как при измерении на постоянном токе она составляет d = D U /U.
Электрокинетические явления. Как было показано выше, на границе твердого тела и электролита происходит скачок потенциала. Заряженный слой жидкости имеет диффузное строение, при котором плотность зарядов быстро убывает с их удалением от поверхности твердого тела. Скачок потенциала в диффузионном слое жидкости называется электрокинетическим потенциалом. В случае если твердое тело является диэлектриком, образование электрокинетического потенциала обусловлено неодинаковой адсорбцией ионов обоих знаков.
Если на концах капилляра или пористой перегородки поместить электроды и создать электрическое поле, то возникнет движение жидкости в капилляре. Это явление называется электроосмосом. Скорость течения жидкости в результате электроосмоса определяется выражением:
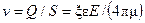 ,
,
где E – напряженность электрического поля в капилляре, В/м; S – сечение капилляра (или сумма сечений пор), м2; e – диэлектрическая постоянная жидкости, Ф/м; m – динамическая вязкость жидкости, Па∙с; x–электрокинетический потенциал, В; Q –расход жидкости, м3/с.
Если твердая фаза образована частицами, взвешенными в жидкости, то эти частицы, получив тот или иной заряд, движутся от одного электрода к другому в неподвижной жидкости. Такое движение частиц называется электрофорезом, или катафорезом.
Явление электроосмоса обратимо. При принудительном протекании жидкости через капилляр или пористую перегородку между электродами возникает разность потенциалов – так называемый потенциал течения
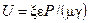 ,
,
где Р – гидростатическое давление (перепад давления), Па; g — удельная проводимость жидкости, См/м.
 2015-01-30
2015-01-30 781
781







