.Атомарный азот намного активнее молекулярного: в частности, при обычной температуре он реагирует с серой, фосфором, мышьяком и с рядом металлов, например, со ртутью.
Вследствие большой прочности молекулы азота некоторые его соединения эндотермичны (многие галогениды, азиды, оксиды), то есть энтальпия их образования положительна, а соединения азота термически малоустойчивы и довольно легко разлагаются при нагревании. Именно поэтому азот на Земле находится по большей части в свободном состоянии.
Ввиду своей значительной инертности азот при обычных условиях реагирует только с литием:
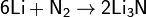
при нагревании он реагирует с некоторыми другими металлами и неметаллами, также образуя нитриды:
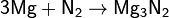
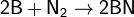
Наибольшее практическое значение имеет нитрид водорода (аммиак) NH3, получаемый взаимодействием водорода с азотом.
В электрическом разряде реагирует с кислородом, образуя оксид азота(II) NO.
Описано несколько десятков комплексов с молекулярным азотом.
Оксиды азота (I, II, III, IV, V). Строение молекул. Молекулы NO и NO2. Прин-ципы получения и химические свойства. Термодинамические характеристики реакции синтеза оксида азота (II) из простых веществ. Азотистая и азотная кислоты и их соли. Окислительные свойства концентрированной и разбавленной азотной кислоты. Токсичность нитратов. Азотные удобрения.
Оксид азота (I) Формула - N2O. Иногда его могут называть оксонитридом азота, оксидом диазота, закисью азота или веселящим газом. Свойства. В обычных условиях представлен бесцветным газом, имеющим сладковатый запах. Его могут растворять вода, этанол, эфир и серная кислота. Если газобразный оксид одновалентного азота нагреть до комнатной температуры под давлением 40 атмосфер, то он сгущается до бесцветной жидкости. Это несолеобразующий оксид, разлагающийся во время нагревания и показывающий себя в реакциях как восстановитель.. Этот оксид образуется, когда нагревают сухой нитрат аммония. Другой способ его получения - термическое разложение смеси "сульфаминовая + азотная кислота". Применение. Используется в качестве средства для ингаляционного наркоза, пищевая промышленность знает этот оксид как добавку E942. С его помощью также улучшают технические характеристики двигателей внутреннего сгорания.
Оксид азота (II) Формула - NO. Встречается под названиями монооксида азота, окиси азота и нитрозил-радикала. Свойства. При нормальных условиях имеет вид бесцветного газа, который плохо растворяется в воде. Его трудно сжижить, однако в твердом и жидком состояниях это вещество имеет голубой цвет. Данный оксид может окисляться кислородом воздуха. Получение. Его довольно просто получить, для этого нужно нагреть до 1200-1300оС смесь азота и кислорода. В лабораторных условиях он образуется сразу при нескольким опытах: Реакция меди и 30%-ного раствора азотной кислоты. Взаимодействие хлорида железа, нитрита натрия и соляной кислоты. Реакция азотистой и иодоводородной кислот. Применение. Это одно из веществ, из которых получают азотную кислоту.
Оксид азота (III) Формула - N2O3. Также его могут называть азотистым ангидридом и сесквиоксидом азота. Свойства. В нормальных условиях является жидкостью, которая имеет синий цвет, а в стандартных - бесцветным газом. Чистый оксид существует только в твердом агрегатном состоянии. Получение. Образуется при взаимодействии 50%-ной азотной кислоты и твердого оксида трехвалентного мышьяка (его также можно заменить крахмалом). Применение. С помощью этого вещества в лабораториях получают азотистую кислоту и ее соли.
Оксид азота (IV) Формула - NO2. Также его могут называть диоксидом азота или бурым газом. Свойства. Последнее название соответствует одному из его свойств. Ведь этот оксид имеет вид или красно-бурого газа или желтоватой жидкости. Ему присуща высокая химическая активность. Получение. Данный оксид получают при взаимодействии азотной кислоты и меди, а также во время термического разложения нитрата свинца. Применение. С помощью него производят серную и азотную кислоты, окисляют жидкое ракетное топливо и смесевые взрывчатые вещества.
Оксид азота(V) Формула - N2O5. Может встречаться под названиями пентаоксида диазота, нитрата нитроила или азотного ангидрида. Свойства. Имеет вид бецветных и очень летучих кристаллов. Они могут плавиться при температуре 32,3оС. Получение. Этот оксид образуется при нескольких реакциях: 1.Дегидрация азотной кислоты оксидом пятивалентного фосфора. 2.Пропускание сухого хлора над нитратом серебра. 3.Взаимодействие озона с оксидом четырехвалентного азота. Применение. Из-за своей крайней неустойчивости в чистом виде нигде не используется.
В химии существует девять оксидов азота, приведенные выше являются только классическими соединениями этого элемента. Остальные четыре - это, как уже было сказано, нестабильные вещества. Однако их все объединяет одно свойство - высокая токсичность. Выбросы оксидов азота в атмосферу приводят к ухудшению состояния здоровья живущих поблизости от промышленных химических предприятий людей. Симптомы отравления каким-либо из этих веществ - токсический отек легких, нарушение работы центральной нервной системы и поражение крови, причина которого - связывание гемоглобина. Поэтому с оксидами азота необходимо осторожно обращаться и в большинстве случаев использовать средства защиты.
Оксид азота (IV) (диоксид азота) NO2 — газ, красно-бурого цвета, с характерным острым запахом или желтоватая жидкость.
В обычном состоянии NO2 существует в равновесии со своим димером N2O4. Склонность к его образованию объясняется наличием в молекуле NO2 неспаренного электрона. При температуре 140 °C диоксид азота состоит только из молекул NO2, он очень тёмного, почти чёрного цвета. В точке кипения NO2 представляет собой желтоватую жидкость, содержащую около 0,1 % NO2. При температуре ниже 21°С — это бесцветная жидкость (или желтоватая из-за примеси мономера). При температуре ниже −12 °C белые кристаллы состоят только из молекул N2O4.
В лаборатории NO2 обычно получают воздействием концентрированной азотной кислотой на медь:
Cu + 4HNO3 (конц.) > Cu(NO3)2 + 2NO2^ + 2H2O.
Также его можно получить термическим разложением нитрата свинца, однако при проведении реакции следует соблюдать осторожность:
2Pb(NO3)2 > 2PbO + 4NO2^ + O2^.
 2015-01-30
2015-01-30 2927
2927
