Простагландины обозначают символами, например PG А, где PG обозначает слово "простагландин", а буква А обозначает заместитель в пятичленном кольце в молекуле эйкозаноида. Каждая из указанных групп простагландинов состоит из 3 типов молекул, отличающихся по числу двойных связей в боковых цепях. Число двойных связей обозначают нижним цифровым индексом, например, PG Е2. Число двойных связей в боковых цепях простагландинов зависит от структуры предшественника - полистовой кислоты, из которой образовались простагландины. Две двойные связи полиеновой кислоты используются при образовании кольца в молекуле простагландина, а количество оставшихся двойных связей в радикалах, связанных с кольцом, определяет серию простагландина: 1 - если одна двойная связь, 2 - если две двойные связи и 3 - если в радикалах имеются три двойных связи. PG I - простациклины. Имеют 2 кольца в своей структуре: одно пятичленное, как и другие простагландины, а другое - с участием атома кислорода. Их также подразделяют в зависимости от количества двойных связей в радикалах (PG I2, PG I3).
Тромбоксаны. В отличие от простагландинов, тромбоксаны синтезируются только в тромбоцитах, откуда и происходит их название, и стимулируют их агрегацию при образовании тромба.мТромбоксаны имеют шестичленное кольцо, включающее атом кислорода. Так же, как и другие эйкозаноиды, тромбоксаны могут содержать различное число двойных связей в боковых цепях, образуя ТХ А2, или ТХ A3, отличающиеся по активности. ТХ В2 - продукт катаболизма ТХ А2 и активностью не обладает.
Циклооксигеназный путь: синтез простагландинов и тромбоксанов
Активация фосфолипаз. Синтез проетагландинов начинается только после отделения полиеновых кислот от фосфолипида мембраны под действием ферментов. Активация фосфолипаз, ассоциированных с мембранами, происходит под действием многих факторов: гормонов, гистамина, цитокинов, механического воздействия. Связывание стимулирующего агента с рецептором может активировать или фосфолипазу А2 или фосфолипазу С. Это зависит от типа клетки и типа рецепторов. После отделения арахидоновой кислоты от фосфолипида она выходит в цитозоль и в различных типах клеток превращается в разные эйкозаноиды. В клетках имеется 2 основных пути превращения арахидоновой кислоты: циклооксигеназный, приводящий к синтезу простагландинов, простациклинов и тромбоксанов, и липоксигеназный, заканчивающийся образованием лейкотриенов или других эйкозаноидов
Синтез простагландинов. Фермент, катализирующий первый этап синтеза простагландинов, называется PG Н2 синтазой и имеет 2 каталитических центра. Один из них называют циклооксигеназой, другой - пероксидазой. Этот фермент представляет собой димер гликопротеинов, состоящий из идентичных полипептидных цепей. Фермент имеет гидрофобный домен, погружённый в липидный слой мембран ЭР, и каталитический домен, обращённый в полость ЭР. В активном центре циклооксигеназы находится тирозин (385), в активном центре пероксидазы - простетическая группа - гем. В организме имеются 2 типа циклооксигеназ (PG Н2 синтаз). Циклооксигеназа 1 - конститутивный фермент, синтезирующийся с постоянной скоростью. Синтез циклооксигеназы 2 увеличивается при воспалении и индуцируется соответствующими медиаторами - цитокинами. тОба типа циклооксигеназ катализируют включение 4 атомов кислорода в арахидоновую кислоту и формирование пятичленного кольца. В результате образуется нестабильное гидропероксидпроизводное, называемое PG G2. Гидропероксид у 15-го атома углерода быстро восстанавливается до гидроксильной группы пероксидазой с образованием PG Н2. До образования PG Н2 путь синтеза разных типов простагландинов одинаков. Дальнейшие превращения PG Н2специфичны для каждого типа клеток.Например, PG Н2 в клетках ГМК может быть восстановлен под действием PG E синтазы с образованием PG Е2 или под действием PG D синтазы с образованием PG D2. В тромбоцитах содержится фермент тромбоксансинтаза, превращающий тот же исходный PG Н2 в ТХ А2обладающий сильным сосудосуживающим действием. В клетках эндотелия под действием фермента простациклинсинтазы из PG Н2 синтезируется PG I2 (простациклин), имеющий сосудорасширяющее действие.
Структура и синтез лейкотриенов, ГЭТЕ, липоксинов. Лейкотриены также образуются из эйкозаноевых кислот, однако в их структуре отсутствуют циклы, как у простагландинов, и они имеют 3 сопряжённые двойные связи, хотя общее число двойных связей в молекуле больше. Лейкотриены С4, D4 и Е4 имеют заместители в виде трипептида глутатиона, дипептида глицилцистеина или цистеина, соответственно. Липоксигеназный путь синтеза, приводящий к образованию большого количества разных эйкозаноидов, начинается с присоединения молекулы кислорода к одному из атомов углерода у двойной связи, с образованием гидропероксидов - гидропероксидэйкозатетраеноатов (ГПЭ-ТЕ). Далее гидропероксиды превращаются в соответствующие гидроксиэйкозатетроеноаты (ГЭТЕ).
Структура и синтез лейкотриенов и ГЭТЕ Синтез лейкотриенов идёт по пути, отличному от пути синтеза простагландинов, и начинается с образования гидроксипероксидов - гидропероксидэйкозатетраеноатов (ГПЭТЕ). Эти вещества или восстанавливаются с образованием гидроксиэйкозатетроеноатов (ГЭТЕ) или превращаются в лейкотриены или липоксины. ГЭТЕ отличаются по положению гидроксильной группы у 5-го, 12-го или 15-го атома углерода, например: 5-ГЭТЕ, 12-ГЭТЕ.Липоксигеназы действуют в 5-й, 12-й или 15-й позиции арахидоновой кислоты в зависимости от типа ткани. Например, в ПЯЛ содержится в основном 5-липоксигеназа, в тромбоцитах - 12-липоксигеназа, в эозинофилах - 15-липоксигеназа.В лейкоцитах и тучных клетках 5-ГПЭТЕ превращается в эпоксидлейкотриен А4 (LT А4), где нижний индекс 4 обозначает общее количество двойных связей. Наличие 3 сопряжённых двойных связей обусловливает название "лейкотриен".
Структура и синтез лейкотриенов, ГЭТЕ, липоксинов Лейкотриены также образуются из эйкозаноевых кислот, однако в их структуре отсутствуют циклы, как у простагландинов, и они имеют 3 сопряжённые двойные связи, хотя общее число двойных связей в молекуле больше. Лейкотриены С4, D4 и Е4 имеют заместители в виде трипептида глутатиона, дипептида глицилцистеина или цистеина, соответственно. Липоксигеназный путь синтеза, приводящий к образованию большого количества разных эйкозаноидов, начинается с присоединения молекулы кислорода к одному из атомов углерода у двойной связи, с образованием гидропероксидов - гидропероксидэйкозатетраеноатов (ГПЭ-ТЕ). Далее гидропероксиды превращаются в соответствующие гидроксиэйкозатетроеноаты (ГЭТЕ).
Структура и синтез лейкотриенов и ГЭТЕ Синтез лейкотриенов идёт по пути, отличному от пути синтеза простагландинов, и начинается с образования гидроксипероксидов - гидропероксидэйкозатетраеноатов (ГПЭТЕ). Эти вещества или восстанавливаются с образованием гидроксиэйкозатетроеноатов (ГЭТЕ) или превращаются в лейкотриены или липоксины. ГЭТЕ отличаются по положению гидроксильной группы у 5-го, 12-го или 15-го атома углерода, например: 5-ГЭТЕ, 12-ГЭТЕ. Липоксигеназы действуют в 5-й, 12-й или 15-й позиции арахидоновой кислоты в зависимости от типа ткани. Например, в ПЯЛ содержится в основном 5-липоксигеназа, в тромбоцитах - 12-липоксигеназа, в эозинофилах - 15-липоксигеназа. В лейкоцитах и тучных клетках 5-ГПЭТЕ превращается в эпоксидлейкотриен А4 (LT А4), где нижний индекс 4 обозначает общее количество двойных связей. Наличие 3 сопряжённых двойных связей обусловливает название "лейкотриен". Другие типы лейкотриенов образуются из LT А4. LT В4 образуется под действием эпоксидгидролазы в лейкоцитах и клетках эпителия сосудов. Другой путь приводит к образованию группы лейкотриенов: LT C4, LT D4, LT E4. Их синтез начинается с присоединения трипепти-да глутатиона к 6-му атому углерода с образованием LT С4 в реакции, катализируемой глутатион-8-трансферазой. В следующей реакции удаляется глутамат, и LT D4 содержит дипептид глицилцистеин. На последней стадии отщепляется глицин, и LT Е4 содержит только цистеин. Липоксины (например, основной липоксин А4) включают 4 сопряжённых двойных связи и 3 гидроксильных группы. Синтез липоксинов начинается с действия на арахидоновую кислоту 15-липоксигеназы, затем происходит ряд реакций, приводящих к образованию липоксина А4
Эйкозаноиды - гормоны местного действия по ряду признаков:
- образуются в различных тканях и органах, а не только в эндокринных железах;
- действуют по аутокринному или паракринному механизмам;
- концентрация эйкозаноидов в крови меньше, чем необходимо, чтобы вызвать ответ в клетках-мишенях.
Только при некоторых патологических состояниях эйкозаноиды могут оказывать системное действие, если их концентрация в крови увеличивается до количеств, когда они могут оказать действие на ГМК всего органа, например кишечника, лёгких, кровеносных сосудов.
70.Холестерин как предшественник ряда других стероидов. Представление о биосинтезе холестерина. Написать ход реакций до образования мевалоновой кислоты. Роль гидроксиметилглутарил-КоА-редуктазы.
Холестерол - стероид, характерный только для животных организмов. Он синтезируется во многих тканях человека, но основное место синтеза - печень. В печени синтезируется более 50% холестерола, в тонком кишечнике - 15- 20%, остальной холестерол синтезируется в коже, коре надпочечников, половых железах. В сутки в организме синтезируется около 1 г холестерола; с пищей поступает 300-500 мг Холестерол выполняет много функций: входит в состав всех мембран клеток и влияет на их свойства, служит исходным субстратом в синтезе жёлчных кислот и стероидных гормонов. Предшественники в метаболическом пути синтеза холестерола превращаются также в убихинон - компонент дыхательной цепи и долихол, участвующий в синтезе гликопротеинов. Холестерол за счёт своей гидроксильной группы может образовывать эфиры с жирными кислотами. Этерифицированный холестерол преобладает в крови и запасается в небольших количествах в некоторых типах клеток, использующих его как субстрат для синтеза других веществ. Холестерол и его эфиры - гидрофобные молекулы, поэтому они транспортируются кровью только в составе разных типов ЛП. Обмен холестерола чрезвычайно сложен - только для его синтеза необходимо осуществление около 100 последовательных реакций. Всего в обмене холестерола участвует около 300 разных белков. Нарушения обмена холестерола приводят к одному из наиболее распространённых заболеваний - атеросклерозу. Смертность от последствий атеросклероза (инфаркт миокарда, инсульт) лидирует в общей структуре смертности населения. Атеросклероз - "полигенное заболевание", т.е. в его развитии участвуют многие факторы, важнейшие из которых наследственные. Накопление холестерола в организме приводит к развитию и другого распространённого заболевания - желчнокаменной болезни.
Синтез холестерола и егорегуляция Реакции синтеза холестерола происходят в цитозоле клеток. Это один из самых длинных метаболических путей в организме человека.
Образованиемевалоната
Сложный путь синтеза холестерола можно разделить на 3 этапа

Первый этап заканчивается образованием мевалоната (мевалоновой кислоты). Две молекулы ацетил-КоА конденсируются ферментом тиолазой с образованием ацетоацетил-КоА. Фермент щдроксиметилглутарил-КоА-синтаза присоединяет третий ацетильный остаток с образованием ГМГ-КоА (3-гидрокси-3-метилглутарил-КоА). Эта последовательность реакций сходна с начальными стадиями синтеза кетоновых тел:
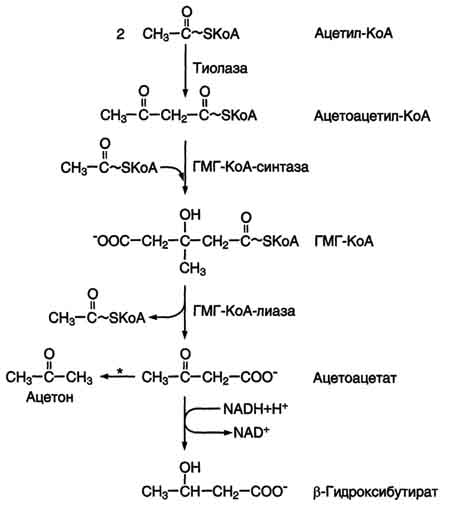
Следующая реакция, катализируемая ГМГ-КоА-редуктазой, является регуляторной в метаболическом пути синтеза холестерола. В этой реакции происходит восстановление ГМГ-КоА до мевалоната с использованием 2 молекул NADPH. Фермент ГМГ-КоА-редуктаза - гликопротеин, пронизывающий мембрану ЭР, активный центр которого выступает в цитозоль.
Образование сквалена На втором этапе синтеза мевалонат превращается в пятиуглеродную изопреноидную структуру, содержащую пирофосфат - изопентенилпирофосфат. Продукт конденсации 2 изопреновых единиц - геранилпирофосфат. Присоединение ещё 1 изопреновой единицы приводит к образованию фарнезилпирофосфата - соединения, состоящего из 15 углеродных атомов. Две молекулы фарнезилпирофосфата конденсируются с образованием сквалена - углеводорода линейной структуры, состоящего из 30 углеродных атомов.
Образование холестерола. На третьем этапе синтеза холестерола сквален через стадию образования эпоксида ферментом циклазой превращается в молекулу ланостерола, содержащую 4 конденсированных цикла и 30 атомов углерода. Далее происходит 20 последовательных реакций, превращающих ланостерол в холестерол. На последних этапах синтеза от ланостерола отделяется 3 атома углерода, поэтому холестерол содержит 27 углеродных атомов.У холестерола имеется насыщенная разветвлённая боковая цепь из 8 углеродных атомов в положении 17, двойная связь в кольце В между атомами углерода в положениях 5 и 6, а также гидроксильная группа в положении 3.В организме человека изопентенилпирофосфат также служит предшественником убихинона (KoQ) и долихола, участвующего в синтезе гликопротеинов.
Этерификация холестерола. В некоторых тканях гидроксильная группа холестерола этерифицируется с образованием более гидрофобных молекул - эфиров холестерола. Реакция катализируется внутриклеточным ферментом АХАТ (ацилКоА:холестеролаиилтрансферазой). Реакция этерификации происходит также в крови в ЛПВП, где находится фермент ЛХАТ (лецитин:холестеролацилтрансфераза). Эфиры холестерола - форма, в которой они депонируются в клетках или транспортируются кровью. В крови около 75% холестерола находится в виде эфиров.
71.Синтез желчных кислот из холестерина. Конъюгация желчных кислот, первичные и вторичные желчные кислоты. Выведение желчных кислот и холестерина из организма.
Жёлчные кислоты синтезируются в печени из холестерола. Часть жёлчных кислот в печени подвергается реакции конъюгации - соединения с гидрофильными молекулами (глицином и таурином). Жёлчные кислоты обеспечивают эмульгирование жиров, всасывание продуктов их переваривания и некоторых гидрофобных веществ, поступающих с пищей, например жирорастворимых витаминов и холестерола. Жёлчные кислоты также всасываются, через юротную вену попадают опять в печень и многократно используются для эмульгирования жиров. Этот путь называют энтерогепатической циркуляцией жёлчных кислот.
Синтез жёлчных кислот. В организме за сутки синтезируется 200- 600 мг жёлчных кислот. Первая реакция синтеза – образование 7-α-гидроксихолестерола - является регуляторной. Фермент 7-α-гидроксилаза, катализирующий эту реакцию, ингибируется конечным продуктом - жёлчными кислотами. 7-α-Гидроксилаза представляет собой одну из форм цитохрома Р450 и использует кислород как один из субстратов. Один атом кислорода из О2 включается в гидроксильную группу в положении 7, а другой восстанавливается до воды. Последующие реакции синтеза приводят к формированию 2 видов жёлчных кислот: холевой и хенодезоксихолевой, которые называют "первичными жёлчными кислотами".
Конъюгирование жёлчных кислот. Конъюгирование - присоединение ионизированных молекул глицина или таурина к карбоксильной группе жёлчных кислот; усиливает их детергентные свойства, так как увеличивает амфифильность молекул. Конъюгация происходит в клетках печени и начинается с образования активной формы жёлчных кислот - производных КоА. Затем присоединяется таурин или глицин, и в результате образуется 4 варианта конъюгатов: таурохолевая и таурохенодезоксихолевая, гликохолевая или гликохенодезоксихолевая кислоты (они значительно более сильные эмульгаторы, чем исходные жёлчные кислоты). Конъюгатов с глицином образуется в 3 раза больше, чем с таурином, так как количество таурина ограничено.
Энтерогепатическая циркуляция жёлчных кислот. Превращения жёлчных кислот в кишечнике. Продукты гидролиза жиров всасываются в основном в верхнем отделе тонкого кишечника, а соли жёлчных кислот - в подвздошной кишке. Около 95% жёлчных кислот, попавших в кишечник, возвращается в печень через воротную вену, затем опять секретируются в жёлчь и повторно используются в эмульгировании жиров. Этот путь жёлчных кислот называют энтерогепатической циркуляцией. В сутки всего реабсорбируется 12-32 г солей жёлчных кислот, так как в организме имеется 2-4 г жёлчных кислот, и каждая молекула жёлчной кислоты проходит этот крут 6-8 раз. Часть жёлчных кислот в кишечнике подвергается действию ферментов бактерий, которые отщепляют глицин и таурин, а также гидроксильную группу в положении 7 жёлчных кислот. Жёлчные кислоты, лишённые этой гидроксильной группы, называют вторичными. Вторичные жёлчные кислоты: дезоксихолевая, образующаяся из холевой, и литохолевая, образующаяся из дезоксихолевой, хуже растворимы, медленнее всасываются в кишечнике, чем первичные жёлчные кислоты. Поэтому с фекалиями в основном удаляются вторичные жёлчные кислоты. Однако реабсорбированные вторичные жёлчные кислоты в печени опять превращаются в первичные и участвуют в эмульгировании жиров. За сутки из организма выводится 500-600 мг жёлчных кислот. Путь выведения жёлчных кислот одновременно служит и основным путём выведения холестерола из организма. Для восполнения потери жёлчных кислот с фекалиями в печени постоянно происходит синтез жёлчных кислот из холестерола в количестве, эквивалентном выведенным жёлчным кислотам. В результате пул жёлчных кислот (2-4 г) остаётся постоянным.
Выведение холестерола из организма. Структурная основа холестерола - кольца циклопентанпергидрофенантрена - не может быть расщеплена до СО2 и воды, как другие органические компоненты, поступающие с пищей или синтезированные в организме. Поэтому основное количество холестерола выводится в виде жёлчных кислот.
Некоторое количество жёлчных кислот выделяется в неизменённом виде, а часть подвергается действию ферментов бактерий в кишечнике. Продукты их разрушения (в основном, вторичные жёлчные кислоты) выводятся из организма.
Часть молекул холестерола в кишечнике под действием ферментов бактерий восстанавливается по двойной связи в кольце В, в результате чего образуютря 2 типа молекул - холестанол и копростанол, выводимые с фекалиями. В сутки из организма выводится от 1,0 г до 1,3 г холестерола, основная часть удаляется с фекалиями,
72.ЛПНП и ЛПВП - транспортные, формы холестерина в крови, роль в обмене холестерина. Гиперхолестеринемия. Биохимические основы развития атеросклероза.
Холестерол транспортируется кровью только в составе ЛП. ЛП обеспечивают поступление в ткани экзогенного холестерола, определяют потоки холестерола между органами и выведение избытка холестерола из организма.
Транспорт экзогенного холестерола. Холестерол поступает с пищей в количестве 300-500 мг/сут, в основном в виде эфиров. После гидролиза, всасывания в составе мицелл, этерификации в клетках слизистой оболочки кишечника эфиры холестерола и небольшое количество свободного холестерола включаются в состав ХМ и поступают в кровь. После удаления жиров из ХМ под действием ЛП-липазы холестерол в составе остаточных ХМ доставляется в печень. Остаточные ХМ взаимодействуют с рецепторами клеток печени и захватываются по механизму эндоцитоза. Затем ферменты лизосом гидролизуют компоненты остаточных ХМ, и в результате образуется свободный холестерол. Экзогенный холестерол, поступающий таким образом в клетки печени, может ингибировать синтез эндогенного холестерола, замедляя скорость синтеза ГМГ-КоА-редуктазы.
Транспорт эндогенного холестерола в составе ЛПОНП (пре-β-липопротеинов). Печень - основное место синтеза холестерола. Эндогенный холестерол, синтезированный из исходного субстрата ацетил-КоА, и экзогенный, поступивший в составе остаточных ХМ, образуют в печени общий фонд холестерола. В гепатоцитах триацилглицеролы и холестерол упаковываются в ЛПОНП. В их состав входят, кроме того, апопротеин В-100 и фоефолипиды. ЛПОНП сек-ретируются в кровь, где получают от ЛПВП апопротеины Е и С-IIВ крови на ЛПОНП действует ЛП-липаза, которая, как и в ХМ, активируется апоС-II гидролизует жиры до глицерола и жирных кислот. По мере уменьшения количества ТАГ в составе ЛПОНП они превращаются в ЛППП. Когда количество жиров в ЛППП уменьшается, апопротеины С-II реносятся обратно на ЛПВП. Содержание холестерола и его эфиров в ЛППП достигает 45%; часть этих липопротеинов захватывается клетками печени через рецепторы ЛПНП, которые взаимодействуют и с апоЕ и с апоВ-100.
Транспорт холестерола в составе ЛПНП. Рецепторы ЛПНП. На ЛППП, оставшиеся в крови, продолжает действовать ЛП-липаза, и они превращаются в ЛПНП, содержащие до 55% холестерола и его эфиров. Апопротеины Е и С-II реносятся обратно в ЛПВП. Поэтому основным апопротеином в ЛПНП служит апоВ-100. Апопротеин В-100 взаимодействует с рецепторами ЛПНП и таким образом определяет дальнейший путь холестерола. ЛПНП - основная транспортная форма холестерола, в которой он доставляется в ткани. Около 70% холестерола и его эфиров в крови находится в составе ЛПНП. Из крови ЛПНП поступают в печень (до 75%) и другие ткани, которые имеют на своей поверхности рецепторы ЛПНП. Рецептор ЛПНП - сложный белок, состоящий из 5 доменов и содержащий углеводную часть. Рецепторы ЛПНП синтезируются в ЭР и аппарате Гольджи, а затем экспонируются на поверхности клетки, в специальных углублениях, выстланных белком клатрином. Эти углубления называют окаймлёнными ямками. Выступающий на поверхность N-концевой домен рецептора взаимодействует с белками апоВ-100 и апоЕ; поэтому он может связывать не только ЛПНП, но и ЛППП, ЛПОНП, остаточные ХМ, содержащие эти апопротеины. Клетки тканей содержат большое количество рецепторов ЛПНП на своей поверхности: например, на одной клетке фибробласта имеется от 20 000 до 50 000 рецепторов. Из этого следует, что холестерол поступает в клетки из крови в основном в составе ЛПНП. Если количество холестерола, поступающего в клетку, превышает её потребность, то синтез рецепторов ЛПНП подавляется, что уменьшает поток холестерола из крови в клетки. При снижении концентрации свободного холестерола в клетке, наоборот, активируется синтез ГМГ-КоА-редуктазы и рецепторов ЛПНП. В регуляции синтеза рецепторов ЛПНП участвуют гормоны: инсулин и трийодтиронин (Т3), полрвые гормоны. Они увеличивают образование рецепторов ЛПНП, а глюкокортикоиды (в основном кортизол) уменьшают. Эффекты инсулина и Т3, вероятно, могут объяснить механизм гиперхолестеролемии и увеличение риска атеросклероза при сахарном диабете или гипотиреозе.
Роль ЛПВП в обмене холестерола. ЛПВП выполняют 2 основные функции: они поставляют апопротеины другим ЛП в крови и участвуют в так называемом "обратном транспорте холестерола". ЛПВП синтезируются в печени и в небольшом количестве в тонком кишечнике в виде "незрелых липопротеинов" - предшественников ЛПВП. Они имеют дисковидную форму, небольшой размер и содержат высокий процент белков и фосфолипидов. В печени в ЛПВП включаются апопротеины А, Е, С-II, фермент ЛХАТ. В крови апоС-II и апоЕ переносятся с ЛПВП на ХМ и ЛПОНП. Предшественники ЛПВП пракгически не содержат холестерола и ТАГ и в крови обогащаются холестеролом, получая его из других ЛП и мембран клеток. Для переноса холестерола в ЛПВП существует сложный механизм. На поверхности ЛПВП находится фермент ЛХАТ - лецитишхолестерол-ацилтрансфераза. Этот фермент превращает холестерол, имеющий гидроксильную группу, выступающую на поверхность липопротеинов или мембран клеток, в эфиры холестерола. Радикал жирной кислоты переносится от фосфатидилхолита (лецитина) на гидроксильную группу холестерола. Реакция активируется апопротеином A-I, входящим в состав ЛПВП. Гидрофобная молекула, эфира холестерола перемещается внутрь ЛПВП. Таким образом, частицы ЛПВП обогащаются эфирами холестерола. ЛПВП увеличиваются в размерах, из дисковидных небольших частиц превращаются в частицы сферической формы, которые называют ЛПВП3, или "зрелые ЛПВП". ЛПВП3 частично обменивают эфиры холестерола на триацилглицеролы, содержащиеся в ЛПОНП, ЛППП и ХМ. В этом переносе участвует " белок, переносящий эфиры холестерина" (он также называется aпoD). Таким образом, часть эфиров холестерола переносится на ЛПОНП, ЛППП, а ЛПВП3 за счёт накопления триацилглицеролов увеличиваются в размерах и превращаются в ЛПВП2. ЛПОНП под действием ЛП-липазы превращаются сначала в ЛППП, а затем в ЛПНП. ЛПНП и ЛППП захватываются клетками через рецепторы ЛПНП. Таким образом, холестерол из всех тканей возвращается в печень в основном в составе ЛПНП, но в этом участвуют также ЛППП и ЛПВП2. Практически весь холестерол, который должен быть выведен из организма, поступает в печень и уже из этого органа выделяется в виде производных с фекалиями. Путь возвращения холестерола в печень называют "обратным транспортом" холестерола.
Гиперхолестеролемия. Роль алиментарных факторов в развитии гиперхолестеролемии. Концентрация холестерола в крови взрослых людей составляет 200±50 мг/дл (5,2±1,2 ммоль/л) и, как правило, увеличивается с возрастом. Превышение нормальной концентрации холестерола в крови называют гиперхолестеролемией. Гиперхолестеролемия часто развивается вследствие избыточного поступления холестерола с пищей, а также углеводов и жиров. Гиперкалорийное питание - один из распространённых факторов развития гиперхолестеролемии, так как для синтеза холестерола необходимы только ацетил-КоА, АТФ и NADPH. Все эти субстраты образуются при окислении глюкозы и жирных кислот, поэтому избыточное поступление этих компонентов пищи способствует развитию гиперхолестеролемии. В норме поступление холестерола с пищей снижает синтез собственного холестерола в печени, однако с возрастом эффективность регуляции у многих людей снижается. Правильное питание в течение всей жизни - важнейший фактор профилактики гаперхолестеролемии. Доказана корреляция между увеличением концентрации холестерола в плазме крови и смертностью от заболеваний ССС - инфаркта миокарда и инсульта, развивающихся в результате атеросклероза.
Ген рецептора ЛПНП: структура и типы мутаций. Наследственные факторы играют важную роль в предрасположенности к развитию атеросклероза. Наиболее часто встречаются мутации в структуре гена рецептора ЛПНП. Ген рецептора ЛПНП находится в хромосоме 19 и состоит из 18 экзонов. Различные группы экзонов кодируют различные домены в составе этого белка. Мутации в этом гене подробно изучены и разделены на 4 класса. Первый класс мутаций, наиболее распространённый, приводит к полному отсутствию рецептора; второй класс мутаций характеризуется тем, что рецептор синтезируется, но не может транспортироваться на поверхность клетки; третий класс мутаций соответствует ситуации, когда рецептор транспортируется на поверхность клеток, но не связывает ЛПНП; четвёртый класс мутаций - рецептор связывает ЛПНП, но не происходит эндоцитоз. Изменения структуры рецепторов ЛПНП в результате всех типов мутаций приводит к гиперхолестеролемии; так как ЛПНП не захватываются клетками, и холестерол в составе ЛПНП накапливается в крови.
Семейная гиперхолестеролемия. Любой дефект рецептора ЛПНП или белка апоВ-100, взаимодействующего с ним, приводит к развитию наиболее распространённого наследственного заболевания - семейной гиперхолестеролемии. Причиной этого аутосомно-доминантного заболевания выступают указанные выше мутации в гене рецептора ЛПНП. Гетерозиготы, имеющие один нормальный ген, а другой дефектный, встречаются с частотой 1:500 человек, у некоторых народностей Африки - даже 1:100 человек. Количество рецепторов ЛПНП на поверхности клеток у гетерози-гот снижено вдвое, а концентрация холестерола в плазме, соответственно, вдвое повышается. У гетерозигот концентрация холестерола в крови в 35-40 лет достигает 400-500 мг/дл, что приводит к выраженному атеросклерозу и ранней смерти в результате инфаркта миокарда или инсульта. Гомозиготы встречаются редко - 1:1 000 000 человек. Концентрации холестерола и ЛПНП в крови таких больных уже в раннем детском возрасте увеличены в 5-6 раз. ЛПНП захватываются макрофагами путём фагоцитоза. Макрофаги, нагруженные избытком холестерола и других лигшдов, содержащихся в ЛПНП, откладываются в коже и даже сухожилиях, образуя так называемые ксантомы. Холестерол откладывается также и в стенках артерий, образуя атеросклеротические бляшки. Такие дети без экстренных мер лечения погибают в возрасте 5-6 лет. Лечение данной формы заболевания проводят путём удаления ЛПНП из крови с помощью плазмафереза, но наиболее радикальный метод лечения - трансплантация печени. Печень донора с нормальным количеством рецепторов ЛПНП существенно понижает концентрацию холестерола в крови и предотвращает раннюю смерть от атеросклероза. Кроме генетических дефектов рецептора ЛПНП, причинами гиперхолестеролемии и, следовательно, атеросклероза являются наследственные дефекты в структуре апоВ-100, а также повышенные синтез или секреция апоВ-100 в случае семейной комбинированной гиперли-пидемии, при которой в крови повышены концентрации и холестерола и триацилглицеролов.
Молекулярные механизмы патогенеза атеросклероза
Развитие атеросклероза проходит несколько стадий
Процесс начинается с повреждения эндотелия сосудов, причём повреждение может иметь различные механизмы. Важнейший механизм - повреждение эндотелия за счёт изменённой структуры ЛПНП, например в результате активации свободнорадикального ПОЛ в составе ЛПНП; повреждение провоцируется свободными радикалами, образующимися в процессе метаболизма или поступающими извне. В ходе ПОЛ в ЛПНП изменяется не только структура самих липидов, но и нарушается структура апопротеинов. Окисленные ЛПНП захватываются макрофагами через скевенджер-рецепторы. Этот процесс не регулируется количеством поглощённого холестерола, как в случае его поступления в клетки через специфические рецепторы, поэтому макрофаги перегружаются холестеролом и превращаются в "пенистые клетки", которые проникают в субэндотелиальное пространство. Это приводит к образованию жировых полосок в стенке кровеносных сосудов. На этой стадии эндотелий сосудов может сохранять свою структуру. При увеличении количества "пенистых клеток" происходит повреждение эндотелия сосудов. В норме клетки эндотелия секретируют простагландин I2 (простациклин I2), который ингибирует агрегацию тромбоцитов. При повреждении клеток эндотелия тромбоциты активируются. Во-первых, они секретируют тромбоксан А2 (ТХ А2, который стимулирует агрегацию тромбоцитов, что может привести к образованию тромба в области атеросклеротической бляшки; во-вторых, тромбоциты начинают продуцировать пептид - тромбоцитарный фактор роста, стимулирующий пролиферацию ГМК. ГМК мигрируют из медиального слоя во внутренний слой артериальной стенки и способствуют таким образом росту бляшки. Далее происходит прорастание бляшки фиброзной тканью (коллагеном ластином); клетки под фиброзной оболочкой некротизируются, а холестерол откладывается в межклеточном пространстве. На этой стадии в центре бляшки образуются даже холестериновые кристаллы. На последних стадиях развития бляшка пропитывается солями кальция и становится очень плотной. В области бляшки часто образуются тромбы, перекрывающие просвет сосуда, что приводит к острому нарушению кровообращения в соответствующем участке ткани и развитию инфаркта. Чаще всего атеросклеротические бляшки развиваются в артериях миокарда, поэтому наиболее распространённое заболевание, развивающееся в результате атеросклероза, - инфаркт миокарда.
73. Механизм возникновения желчнокаменной болезни (холестериновые камни). Применение хенодезокеихолевой кислоты для лечения желчнокаменной болезни.
Желчнокаменная болезнь - патологический процесс, при котором в жёлчном пузыре образуются камни, основу которых составляет холестерол.
Выделение холестерола в жёлчь должно сопровождаться пропорциональным выделением жёлчных кислот и фосфолипидов, удерживающих гидрофобные молекулы холестерола в жёлчи в мицеллярном состоянии У большинства больных желчнокаменной болезнью активность ГМГ-КоА-редуктазы повышена, следовательно увеличен синтез холестерола, а активность 7-α-гидроксилазы, участвующей в синтезе жёлчных кислот, снижена. В результате синтез холестерола увеличен, а синтез жёлчных кислот из него замедлен, что приводит к диспропорции количества холестерола и жёлчных кислот," секретируемых в жёлчь.
Если эти пропорции нарушены, то холестерол начинает осаждаться в жёлчном пузыре, образуя вначале вязкий осадок, который постепенно становится более твёрдым. Иногда он пропитывается билирубином - продуктом распада тема, белками и солями кальция. Камни, образующиеся в жёлчном пузыре, могут состоять только из холестерола (холестериновые камни) или из смеси холестерола, билирубина, белков и кальция. Холестериновые камни обычно белого цвета, а смешанные камни - коричневого цвета разных оттенков. Причин, приводящих к изменению соотношения жёлчных кислот и холестерола, в жёлчи много: пища, богатая холестеролом, гиперкалорийное питание, застой жёлчи в жёлчном пузыре, нарушение энтерогепатической циркуляции, нарушения синтеза жёлчных кислот, инфекции жёлчного пузыря. Если камни начинают перемещаться из жёлчного пузыря в жёлчные протоки, то они вызывают спазм жёлчного пузыря и протоков, что больной ощущает как приступ сильной боли. Если камень перекрывает проток некоторое время, то нарушается поступление жёлчи в кишечник, жёлчные пигменты проходят через мембраны гепатоцитов в сторону синусоидов и попадают в кровь, что приводит к развитию об-турационной (подпечёночной желтухи).
Лечение желчнокаменной болезни. В начальной стадии образования камней можно применять в качестве лекарства хенодезоксихолевую кислоту. Попадая в жёлчный пузырь, эта жёлчная кислота постепенно растворяет осадок холестерола (холестериновые камни), однако это медленный процесс, требующий нескольких месяцев.
74. Общая схема источников и путей расходования аминокислот в тканях. Динамическое состояние белков в организме.
Значение аминокислот для организма в первую очередь определяется тем, что они используются для синтеза белков, метаболизм которых занимает особое место в процессах обмена веществ между организмом и внешней средой. Объясняется это тем, что белки входят во все основные структурные компоненты клеток, тканей и органов тела человека и животных, выполняют ферментативные функции, участвуют в переносе веществ через мембраны и т.д. Важную роль в координации работы всех систем клеток играют белковые гормоны. Аминокислоты непосредственно участвуют в биосинтезе не только белков, но и большого количества других биологически активных соединений, регулирующих процессы обмена веществ в организме, таких как нейромедиаторы и гормоны - производные аминокислот. Аминокислоты служат донорами азота при синтезе всех азотсодержащих небелковых соединений, в том числе нуклео-тидов, тема, креатина, холина и других веществ. Катаболизм аминокислот может служить источником энергии для синтеза АТФ. Энергетическая функция аминокислот становится значимой при голодании, некоторых патологических состояниях (сахарный диабет и др.) и преимущественно белковом питании. Именно обмен аминокислот осуществляет взаимосвязь многообразных химических превращений в живом организме. Фонд свободных аминокислот организма составляет примерно 35 г. Содержание свободных аминокислот в крови в среднем равно 35-65 мг/дл. Большая часть аминокислот входит в состав белков, количество которых в организме взрослого человека нормального телосложения составляет примерно 15 кг. Источники свободных аминокислот в клетках - белки пищи, собственные белки тканей и синтез аминокислот из углеводов. Многие клетки, за исключением высокоспециализированных (например, эритроцитов), используют аминокислоты для синтеза белков, а также большого количества других веществ: фосфолипидов мембран, гема, пуриновых и пиримидиновых нуклеотидов, биогенных аминов (катехоламинов, гистамина) и других соединений. Какой-либо специальной формы депонирования аминокислот, подобно глюкозе (в виде гликогена) или жирных кислот (в виде триацилглицеролов), не существует. Поэтому резервом аминокислот могут служить все функциональные и структурные белки тканей, но преимущественно белки мышц, поскольку их больше, чем всех остальных. В организме человека в сутки распадается на аминокислоты около 400 г белков, примерно такое же количество синтезируется. Поэтому тканевые белки не могут восполнять затраты аминокислот при их катаболизме и использовании на синтез других веществ. Первичными источниками аминокислот не могут служить и углеводы, так как из них синтезируются только углеродная часть молекулы большинства аминокислот, а аминогруппа поступает от других аминокислот. Следовательно, основным источником аминокислот организма служат белки пищи.
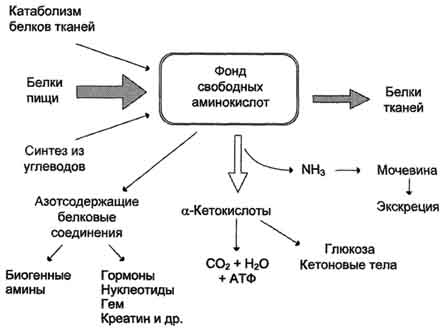
Аминокислоты (свободные и в составе белков) содержат почти 95% всего азота, поэтому именно они поддерживают азотистый баланс организма. Азотистый баланс - разница между количеством азота, поступающего с пищей, и количеством выделяемого азота (преимущественно в виде мочевины и аммонийных солей). Если количество поступающего азота равно количеству выделяемого, то наступает азотистое равновесие. Такое состояние бывает у здорового человека при нормальном питании. Азотистый баланс может быть положительным (азота поступает больше, чем выводится) у детей, а также у пациентов, выздоравливающих после тяжёлых болезней. Отрицательный азотистый баланс (выделение азота преобладает над его поступлением) наблюдают при старении, голодании и во время тяжёлых заболеваний. При безбелковой диете азотистый баланс становится отрицательным. Соблюдение подобной диеты в течение недели приводит к тому, что количество выделяемого азота перестаёт увеличиваться и стабилизируется примерно на величине 4 г/сут. Такое количество азота содержится в 25 г белка. Значит, при белковом голодании в сутки в организме расходуется около 25 г собственных белков тканей. Минимальное количество белков в пище, необходимое для поддержания азотистого равновесия, соответствует 30-50 г/cyт, оптимальное же количество при средней физической нагрузке составляет ∼100-120 г/сут.
75. Переваривание белков. Протеиназы - пепсин, трипсин, химотрипсин; проферменты протеиназ и механизмы их превращения в ферменты. Субстратная специфичность протеиназ. Экзопептидазы и эндопептидазы.
В пищевых продуктах содержание свободных аминокислот очень мало. Подавляющее их количество входит в состав белков, которые гидролизуются в ЖКТ под действием ферментов протеаз (пептидщцролаз). Субстратная специфичность этих ферментов заключается в том, что каждый из них с наибольшей скоростью расщепляет пептидные связи, образованные определёнными аминокислотами. Протеазы, гидролизующие пептидные связи внутри белковой молекулы, относят к группе эндопептидаз. Ферменты, относящиеся к группе экзопептидаз, гидролизуют пептидную связь, образованную концевыми аминокислотами. Под действием всех протеаз ЖКТ белки пищи распадаются на отдельные аминокислоты, которые затем поступают в клетки тканей.
 2015-01-30
2015-01-30 2643
2643








