Желудочный сок - продукт нескольких типов клеток. Обкладочные (париетальные) клетки стенок желудка образуют соляную кислоту, главные клетки секретируют пепсиноген. Добавочные и другие клетки эпителия желудка выделяют муцинсодержащую слизь. Париетальные клетки секретируют в полость желудка также гликопротеин, который называют "внутренним фактором" (фактором Касла). Этот белок связывает "внешний фактор" - витамин В12, предотвращает его разрушение и способствует всасыванию.
Образование и роль соляной кислоты. Основная пищеварительная функция желудка заключается в том, что в нём начинается переваривание белка. Существенную роль в этом процессе играет соляная кислота. Белки, поступающие в желудок, стимулируют выделение гистамина и группы белковых гормонов - гастринов которые, в свою очередь, вызывают секрецию НСI и профермента - пепсиногена. Источником Н+ является Н2СО3, которая образуется в обкладочных клетках желудка из СО2, диффундирующего из крови, и Н2О под действием фермента карбоангидразы (карбонатдегидра-тазы):
Н2О + СО2 → Н2СО3 → НСО3- + H+
Диссоциация Н2СО3 приводит к образованию бикарбоната, который с участием специальных белков выделяется в плазму в обмен на С1-, и ионов Н+, которые поступают в просвет желудка путём активного транспорта, катализируемого мембранной Н+/К+-АТФ-азой. При этом концентрация протонов в просвете желудка увеличивается в 106 раз. Ионы Сl- поступают в просвет желудка через хлоридный канал. Концентрация НСl в желудочном соке может достигать 0,16 М, за счёт чего значение рН снижается до 1,0-2,0. Приём белковой пищи часто сопровождается выделением щелочной мочи за счёт секреции большого количества бикарбоната в процессе образования НСl. Под действием НСl происходит денатурация белков пищи, не подвергшихся термической обработке, что увеличивает доступность пептидных связей для протеаз. НСl обладает бактерицидным действием и препятствует попаданию патогенных бактерий в кишечник. Кроме того, соляная кислота активирует пепсиноген и создаёт оптимум рН для действия пепсина.
Механизм активации пепсина. Под действием гастринов в главных клетках желудочных желёз стимулируются синтез и секреция пепсиногена - неактивной формы пепсина. Пепсиноген - белок, состоящий из одной полипептидной цепи с молекулярной массой 40 кД. Под действием НСl он превращается в активный пепсин (молекулярная масса 32,7 кД) с оптимумом рН 1,0-2,5. В процессе активации в результате частичного протеолиза от N-конца молекулы пепсиногена отщепляются 42 аминокислотных остатка, которые содержат почти все положительно заряженные аминокислоты, имеющиеся в пепсиногене. Таким образом, в активном пепсине преобладающими оказываются отрицательно заряженные аминокислоты, которые участвуют в конформационных перестройках молекулы и формировании активного центра. Образовавшиеся под действием НСl активные молекулы пепсина быстро активируют остальные молекулы пепсиногена (аутокатализ). Пепсин в первую очередь гидролизует пептидные связи в белках, образованные ароматическими аминокислотами (фенилаланин, триптофан, тирозин) и несколько медленнее - образованные лейцином и дикарбоновыми аминокислотами. Пепсин - эндопептидаза, поэтому в результате его действия в желудке образуются более короткие пептиды, но не свободные аминокислоты.
Переваривание белков в кишечнике.
Желудочное содержимое (химус) в процессе переваривания поступает в двенадцатиперстную кишку. Низкое значение рН химуса вызывает в кишечнике выделение белкового гормона секретина, поступающего в кровь. Этот гормон в свою очередь стимулирует выделение из поджелудочной железы в тонкий кишечник панкреатического сока, содержащего НСО3-, что приводит к нейтрализации НСl желудочного сока и ингибированию пепсина. В результате рН резко возрастает от 1,5-2,0 до ∼7,0. Поступление пептидов в тонкий кишечник вызывает секрецию другого белкового гормона - холецистокинина, который стимулирует выделение панкреатических ферментов с оптимумом рН 7,5-8,0. Под действием ферментов поджелудочной железы и клеток кишечника завершается переваривание белков.
Активация панкреатических ферментов В поджелудочной железе синтезируются проферменты ряда протеаз: трипсиноген, химотрипсиноген, проэластаза, прокарбоксипептидазы А и В. В кишечнике они путём частичного протеолиза превращаются в активные ферменты трипсин, химотрипсин, эластазу и карбоксипептидазы А и В.
Активация трипсиногена происходит под действием фермента эпителия кишечника энтеропептидазы. Этот фермент отщепляет с N-конца молекулы трипсиногена гексапептид Вал-(Асп)4-Лиз. Изменение конформации оставшейся части полипептидной цепи приводит к формированию активного центра, и образуется активный трипсин. Последовательность Вал-(Асп)4-Лиз присуща большинству известных трипсиноге-нов разных организмов - от рыб до человека.
Образовавшийся трипсин активирует химотрипсиноген, из которого получается несколько активных ферментов (рис. 9-3). Химотрипсиноген состоит из одной полипептидной цепи, содержащей 245 аминокислотных остатков и пяти дисульфидных мостиков. Под действием трипсина расщепляется пептидная связь между 15-й и 16-й аминокислотами, в результате чего образуется активный π-химотрипсин. Затем под действием π-химотрипсина отщепляется дипептид сер(14)-арг(15), что приводит к образованию δ-химотрипсина. Отщепление дипептида тре(147)-арг(148) завершает образование стабильной формы активного фермента - α-химотрипсина, который состоит из трёх полипептидных цепей, соединённых дисульфидными мостиками. Остальные проферменты панкреатических протеаз (проэластаза и прокарбоксипептидазы А и В) также активируются трипсином путём частичного протеолиза. В результате образуются активные ферменты - эластаза и карбокси-пептидазы А и В.
Специфичность действия протеаз. Трипсин преимущественно гидролизует пептидные связи, образованные карбоксильными группами аргинина и лизина. Химотрипсины наиболее активны в отношении пептидных связей, образованных карбоксильными группами ароматических аминокислот (Фен, Тир, Три). Карбоксипептидазы А и В - цинксодержащие ферменты, отщепляют С-концевые остатки аминокислот. Причём карбоксипептидаза А отщепляет преимущественно аминокислоты, содержащие ароматические или гидрофобные радикалы, а карбоксипептидаза В - остатки аргинина и лизина. Последний этап переваривания - гидролиз небольших пептидов, происходит под действием ферментов аминопептидаз и дипептидаз, которые синтезируются клетками тонкого кишечника в активной форме.
· Аминопептидазы последовательно отщепляют N-концевые аминокислоты пептидной цепи. Наиболее известна лейцинаминопептидаза - Zn2+- или Мn2+-содержащий фермент, несмотря на название, обладающий широкой специфичностью по отношению к N-концевым аминокислотам.
· Дипептидазы расщепляют дипептиды на аминокислоты, но не действуют на трипептиды.
В результате последовательного действия всех пищеварительных протеаз большинство пищевых белков расщепляется до свободных аминокислот.
Экзопептидазы (экзопротеиназы) — ферменты, гидролизующие белки, отщепляя аминокислоты от конца пептида: карбоксипептидазы — от C-конца, аминопептидазы — от N-конца, дипептидазы расщепляют дипептиды. Экзопептидазы синтезируются в клетках тонкого кишечника (аминопептидазы, дипептидазы) и в поджелудочной железе (карбоксипептидаза). Функционируют эти ферменты внутриклеточно в кишечном эпителии и, в небольшом количестве, в просвете кишечника.
Эндопептидазы (эндопротеиназы) — протеолитические ферменты (пепсин, трипсин, химотрипсин), расщепляющие пептидные связи внутри пептидной цепи. С наибольшей скоростью ими гидролизуются связи, образованные определёнными аминокислотами. Эндопептидазы синтезируются в виде проферментов, активируемых затем при помощи избирательного протеолиза. Таким образом клетки, секретирующие эти ферменты защищают собственные белки от разрушения. От действия ферментов клеточную мембрану клеток животных защищает также поверхностный слой олигосахаридов —гликокаликс, а в кишечнике и желудке — слой слизи.
76. Диагностическое значение биохимического анализа желудочного и дуоденального сока. Дать краткую характеристику состава этих соков.
Желудочный сок — сложный по составу пищеварительный сок, вырабатываемый различными клетками слизистой оболочки желудка. Желудочный сок содержит соляную кислоту и ряд минеральных солей, а также различные ферменты, главнейшими из которых являются пепсин, расщепляющий белки, химозин (сычужный фермент), створаживающий молоко, липаза, расщепляющая жиры. Составной частью желудочного сока является также слизь, играющая важную роль в защите слизистой оболочки желудка от раздражающих веществ, попавших в него; при высокой кислотности желудочного сока слизь нейтрализует ее.
Кроме соляной кислоты, ферментов, солей и слизи, в желудочном соке содержится также особое вещество — т. наз. внутренний фактор Касла. Это вещество необходимо для всасывания витамина В12 в тонких кишках, что обеспечивает нормальное созревание красных кровяных телец в костном мозге. При отсутствии фактора Касла в желудочном соке, что обычно связано с заболеванием желудка, а иногда с его оперативным удалением, развивается тяжелая форма малокровия. Анализ желудочного сока является очень важным методом исследования больных с заболеваниями желудка, кишечника, печени, желчного пузыря, крови и пр
|
Дуоденальный сок - пищеварительный сок двенадцатиперстной кишки, состоящий из секрета поджелудочной железы, желчи, сока кишечных крипт и дуоденальных желез.
77. Протеиназы поджелудочной железы и панкреатиты. Применение ингибиторов протеиназ для лечения панкреатитов.
Панкреатический сок имеет высокую концентрацию бикарбонатов, которые обусловливают его щелочную реакцию. Его рН колеблется от 7,5 до 8,8. В соке содержатся хлориды натрия, калия и кальция, сульфаты и фосфаты. Вода и электролиты выделяются в основном центроацинарными и эпителиальными клетками выводах протоков. В состав сока входит и слизь, которая вырабатывается бокаловидными клетками главного протока поджелудочной железы. Панкреатический сок богат ферментами, осуществляющими гидролиз белков, жиров и углеводов. Они вырабатываются ацинарными панкреацитами.
Протеолитические ферменты (трипсин, химотрипсин, эластаза, карбок-сипептидазы А и В) выделяются панкреацитами в неактивном состоянии, что предотвращает самопереваривание клеток.
Трипсин. Трипсиноген и трипсин получены в кристаллическом виде, полностью расшифрована их первичная структура и известен молекулярный механизм превращения профермента в активный фермент. В опытах in vitro превращение трипсиногена в трипсинкатализируют не только энтеропептидаза и сам трипсин, но и другие протеиназы и ионы Са2+.
Активирование трипсиногена химически выражается в отщеплении с N-конца полипептидной цепи 6 аминокислотных остатков (Вал–Асп– Асп–Асп–Асп–Лиз) и соответственно в укорочении полипептидной цепи.
Следует подчеркнуть, что в этом небольшом, казалось бы, химическом процессе – отщепление гексапептида от предшественника – заключено важное биологическое значение, поскольку при этом происходят формирование активного центра и образование трехмерной структуры трипсина, а известно, что и белки биологически активны только в своей нативной трехмерной конформации. В том, что трипсин, как и другие протеиназы, вырабатывается в поджелудочной железе в неактивной форме, также имеется определенный физиологический смысл, поскольку в противном случае трипсин мог бы оказывать разрушающее протеолитическое действие не только на клетки самой железы, но и на другие ферменты, синтезируемые в ней (амилаза, липаза и др.). В то же время поджелудочная железа защищает себя еще одним механизмом – синтезом специфического белка ингибитора панкреатическоготрипсина. Этот ингибитор оказался низкомолекулярным пептидом (мол. масса 6000), который прочно связывается с активными центрами трипсина и химотрипсина, вызывая обратимое их ингибирование. В поджелудочной железе синтезируется также α1-антипротеиназа (мол. масса 50000), которая преимущественно инги-бирует эластазу.
При остром панкреатите, когда трипсин и другие ферменты из пораженной поджелудочной железы «вымываются» в кровь, уровень их вкрови соответствует размерам некротического участка. В этом случае определение активности трипсина в сыворотке крови является надежным ферментным тестом при диагностике острого панкреатита. Следует отметить, что субстратная специфичность трипсинаограничена разрывом только тех пептидных связей, в образовании которых участвуют карбоксильные группы лизина и аргинина.
Химотрипсин. В поджелудочной железе синтезируется ряд химотрип-синов (α-, β- и π-химотрипсины) из двух предшественников – химотрипсиногена А и химотрипсиногена В. Активируются проферменты в кишечнике под действием активного трипсина ихимотрипсина. Полностью раскрыта последовательность аминокислот химотрипсиногена А, во многом сходная с последовательностьюаминокислот трипсина. Молекулярная масса его составляет примерно 25000. Он состоит из одной полипептидной цепи, содержащей 246 аминокислотных остатков. Активация профермента не сопряжена с отщеплением большого участка молекулы. Получены доказательства, что разрыв одной пептидной связи между аргинином и изолейцином в молекуле химотрипсиногена А под действием трипсина приводит к формированию π-химотрипсина, обладающего наибольшей ферментативной активностью. Последующее отщепление дипеп-тида Сер–Арг приводит к образованию δ-химотрипсина. Аутокаталити-ческий процесс активирования, вызванный химотрипсином, сначала способствует формированию неактивного промежуточного неохимотрипсина, который под действием активного трипсина превращается в α-химотрип-син; этот же продукт образуется из δ-химотрипсина, но под действием активного химотрипсина. Таким образом, благодаря совместному перекрестному воздействию химотрипсина и трипсина из химотрипсиногена образуются разные химо-трипсины, различающиеся как ферментативной активностью, так и некоторыми физико-химическими свойствами, в частности электрофорети-ческой подвижностью. Следует отметить, что химотрипсин обладает более широкой субстратной специфичностью, чем трипсин. Он катализирует гидролиз не только пептидов, но и эфиров, гидроксаматов, амидов и других ацилпроизводных, хотя наибольшую активность химотрипсин проявляет по отношению к пептидным связям, в образовании которых принимают участие карбоксильные группы ароматических аминокислот:фенилаланина, тирозина и триптофана.
Эластаза. В поджелудочной железе синтезируется еще одна эндопеп-тидаза – эластаза – в виде проэластазы. Превращениепрофермента в эластазу в тонкой кишке катализируется трипсином. Название фермент получил от субстрата эластина, который он гидролизует. Эластин содержится в соединительной ткани и характеризуется наличием большого числа остатков глицина и серина. Эластаза обладает широкой субстратной специфичностью, но предпочтительнее гидролизует пептидные связи, образованныеаминокислотами с небольшими гидрофобными радикалами, в частности глицином, аланином и серином. Интересно, что ни трипсин, нихимотрипсин не гидролизуют пептидные связи молекулы эластина, хотя все три фермента, включая эластазу, содержат сходные участкиаминокислотных последовательностей и одинаковые места положения дисульфидных мостиков, а также имеют в активном центре один и тот же ключевой остаток серина, что подтверждают опыты с ингибированием всех трех ферментовдиизопропилфторфосфатом, химически связывающим ОН-группу серина. Высказано предположение, что все три эндопептидазы поджелудочной железы: трипсин, химотрипсин и эластаза,– возможно, имеют один и тот же общий предшественник и чтоспецифичность активного фермента в основном определяется конформационными изменениями профермента в процессе активирования.
Экзопептидазы. В переваривании белков в тонкой кишке активное участие принимает семейство экзопептидаз. Одни из них – карбоксипеп-тидазы – синтезируются в поджелудочной железе в виде прокарбоксипеп-тидазы и активируются трипсином в кишечнике; другие – аминопептидазы – секретируются в клетках слизистой оболочки кишечника и также активируются трипсином.
Карбоксипептидазы. Подробно изучены две карбоксипептидазы – А и В, относящиеся к металлопротеинам и катализирующие отщепление от полипептида С-концевых аминокислот. Карбоксипептидаза А разрывает преимущественно пептидные связи, образованные концевыми ароматическими аминокислотами, а карбоксипептидаза В – связи, в образовании которых участвуют С-концевые лизин и аргинин. Очищенный препарат карбокси-пептидазы А обладает бифункциональной активностью – пептидазной и эстеразной и содержит ион Zn2+(один атом на 1 моль фермента). При замене ионов Zn2+на ионы Са2+ полностью утрачивается пепти-дазная активность, но усиливается исходная эстеразная активность, хотя
при этом существенных изменений в третичной структуре фермента не отмечается.
Аминопептидазы. В кишечном соке открыты два фермента – аланин-аминопептидаза, катализирующая преимущественно гидролизпептидной связи, в образовании которой участвует N-концевой аланин, и лейцин-аминопептидаза, не обладающая строгой субстратнойспецифичностью и гидролизующая пептидные связи, образованные любой N-концевой аминокислотой. Оба фермента осуществляют ступенчатое отщепление аминокислот от N-конца полипептидной цепи.
Дипептидазы. Процесс переваривания пептидов, их расщепление до свободных аминокислот в тонкой кишке завершают дипептидазы. Среди дипептидаз кишечного сока хорошо изучена глицилглицин-дипептидаза, гидролизующая соответствующий дипептид до двухмолекул глицина. Известны также две другие дипептидазы: пролил-дипептидаза (пролиназа), катализирующая гидролиз пептидной связи, в образовании которой участвует СООН-группа пролина, и пролин-дипептидаза (пролидаза), гидроли-зующая дипептиды, в которых азот пролина связан кислотно-амидной связью.
78. Трансаминирование: аминотрансферазы; коферментная функция витамина В6. Специфичность аминотрансфераз.
Из реакции переноса NH2 наиболее важны реакции трансаминирования. Они катализируются трансаминазами и участвуют в катаболических и анаболических процессах с участием аминокислот. При трансаминировании аминогруппа аминокислоты(аминокислота 1) переносится на 2-кетокислоту (кетокислота 2). Из аминокислоты при этом образуется 2-кетокислота (а), а из первоначальной кетокислоты — аминокислота (b). Переносимая NH2-группа временно присоединяется к связанному с ферментомпиридоксальфосфату, который вследствие этого переходит в пиридоксаминофосфат.
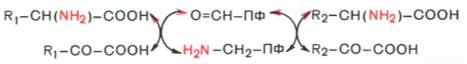
Механизм трансаминирования. В отсутствие субстратов альдегидная группа пиридоксальфосфата ковалентно связана с остатком лизина трансаминазы (1). Этот тип соединения, найденный также в родопсинах (см. с. 346), относится к альдиминам или шиффовым основаниям, во время реакции аминокислота 1 вытесняет остаток лизина и образуется новый альдимин (2). Затем за счет изомеризации происходит перемещение двойной связи. Полученный кетимин (3) гидролизуется до 2-кетокислоты и пиридоксаминфосфата (4). На второй частиреакции те же стадии протекают в противоположном направлении: пиридоксаминфосфат и вторая 2-кетокислота образуют кетимин, который иэомеризуется в альдимин. Наконец, отщепляется вторая аминокислота и регенерируется кофермент.
Аминотрансфера́зы(трансаминазы) — ферменты из группы трансфераз, переносящие аминогруппы без образования свободного аммиака. Аминотрансферазы также называют трансаминазами, а реакцию — трансаминированием. Для аминотрансфераз донором аминогрупп являются аминокислоты, а акцептором — кетокислоты:
AK1 + KK2 ↔ KK1 + AK2
В составе простетической группы аминотрансферазы содержат производные витамина B6. Во время переноса аминогруппы простетическая группа переходит из пиридоксаль-5-фосфатной формы в пиридосамино-5-фосфатную форму. Механизм реакции трансаминирования открыт в 1937 году советскими учеными А.Е. Браунштейном и М.Г.Крицман. Процесс протекает в две стадии. Альдегидная группа пиридоксальфостфата (-СНО) взаимодействует с аминогруппой аминокислоты с образованием иминной связи в основании Шиффа: сначала α-аминогруппа аминокислоты-донора замещает ε-аминогруппуапофермента, а затем происходит перегруппировка через кетимин и в результате гидролиза образуется пиридосамино-5-фосфат и α-кетокислота. Реакции повторяются в обратном порядке
Аминотрансферазы являются каталитически совершенными ферментами. Аминотрансферазы содержаться практически во всех органах, но наиболее активно реакции трансаминирования идут в печени. К этой группе ферментов относятся такие важные для клинической лабораторной диагностики ферменты, как АСТ и АЛТ.
П иридоксальфосфат является простетической группой аминотранс-фераз, катализирующих обратимый перенос аминогруппы (NH2-группы) от аминокислот на α-кетокислоту, и декарбоксилаз аминокислот, осуществляющих необратимое отщепление СО2 от карбоксильной группы аминокислот с образованием биогенных аминов. Установлена кофер-ментная роль пиридоксальфосфата в ферментативных реакцияхнеокислительного дезаминирования серина и треонина, окисления триптофана, кинуренина, превращения серосодержащих аминокислот, взаимопревращения серина и глицина, а также в синтезе δ-аминолевулиновой кислоты, являющейсяпредшественником молекулы гема гемоглобина. В последние годы число вновь открытых пиридокса-левых ферментов быстро увеличивалось. Так, для действия гликогенфос-форилазы существенной оказалась фосфорильная, а не альдегидная группа пиридоксальфосфата. Вследствие широкого участия пиридоксальфосфата в процессах обмена при недостаточности витамина В6 отмечаются разнообразные нарушения метаболизма аминокислот.
79. Аминокислоты, участвующие в трансаминировании; особая роль глутаминовой кислоты. Биологическое значение реакций трансаминирования. Определение трансаминаз в сыворотке крови при инфаркте миокарда и болезнях печени.
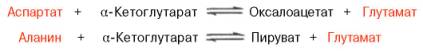
Чрезвычайно широкое распространение трансаминаз в животных тканях, у микроорганизмов и растений, их высокая резистентность к физическим, химическим и биологическим воздействиям, абсолютная стереохимическая специфичность по отношению к L-аминокислотам, а также высокая каталитическая активность в процессах трансаминирования послужили предметом детального исследования роли этих ферментов в обмене аминокислот. Ранее было указано, что при физиологических значениях рН средыактивность оксидазы L-аминокислот резко снижена. Учитывая это обстоятельство, а также высокую скорость протекания реакциитрансами-нирования, А.Е. Браунштейн выдвинул гипотезу о возможности существования в животных тканях непрямого путидезаминирования аминокислот через реакции трансаминирования, названного им трансдезаминированием. Основой для выдвижения этой гипотезы послужили также данные Г. Эйлера о том, что в животных тканях из всех природных аминокислот с высокой скоростью дезаминируется только L-глутаминовая кислота в реакции, катализируемой высокоактивной и специфической глутамат-дегидрогеназой.
Согласно гипотезе, получившей экспериментальное подтверждение, все или почти все природные аминокислоты (исключение составляет метионин) сначала реагируют с α-кетоглутаровой кислотой в реакции трансами-нирования с образованием глутаминовой кислоты и соответствующей кетокислоты. Образовавшаяся глутаминовая кислота затем подвергается непосредственному окислительному дезаминированию под действием глу-таматдегидрогеназы. Суммарная реакция при этом следующая:
R,—CH(NH2)—COOH + НАД++H20-> R,—CO—СООН + НАДН2 + NH3.
Поскольку обе реакции (трансаминирование и дезаминирование глу-таминовой кислоты) являются обратимыми, создаются условия для синтеза по существу любой аминокислоты, если в организме имеются соответствующие α-кетокислоты. Известно, что организмживотных и человека не наделен способностью синтеза углеродных скелетов (α-кетокислот), так называемых незаменимыхаминокислот; этой способностью обладают только растения и многие микроорганизмы. Механизм, при помощи которого в живых организмах осуществляется синтез природных аминокислот из α-кетокислот и аммиака, был назван А.Е. Браунштейном трансреаминированием. Сущность его сводится к восстановительному аминированию α-кетоглутаровойкислоты с образованием глутаминовой кислоты (реакцию катализирует НАДФ-зависимая глута-матдегидрогеназа, работающая в режиме синтеза) и к последующему трансаминированию глутамата с любой α-кетокислотой. В результате образуется L-аминокислота, соответствующая исходной кетокислоте, и вновь освобождается α-кетоглутаровая кислота, которая может акцептировать новуюмолекулу аммиака. Таким образом, трансаминазы катализируют опосредованное через глутаматдегидрогеназу дезаминирование природных аминокислот и биосинтез аминокислот.
Получены доказательства существования в организме теплокровных животных еще одного механизма непрямого (опосредованного) дезаминирования L-аминокислот, при котором Глу, Асп и АМФ выполняют роль системы переноса NН2-группы; гидролитическоедезаминирование АМФ приводит к образованию инозинмонофосфата (ИМФ) и аммиака:
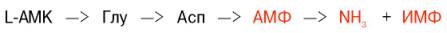
Возможно, что в аналогичной системе в качестве промежуточного переносчика NH2-группы вместо АМФ участвует НАД.
Клиническое значение определения активности трансаминаз. Широкое распространение и высокая активность трансаминаз в органах и тканях человека, а также сравнительно низкие величины активности этих ферментов в крови послужили основанием для определения уровня ряда трансаминаз в сыворотке крови человека при органических и функциональных поражениях разных органов. Для клинических целей наибольшее значение имеют две трансаминазы – аспартат-аминотрансфераза (AcAT)и аланин-аминотрансфераза (АлАТ), катализирующие соответственно следующие обратимые реакции:
В сыворотке крови здоровых людей активность этих трансаминаз в тысячи раз ниже, чем в паренхиматозных органах. Поэтому органические поражения при острых и хронических заболеваниях, сопровождающиеся деструкцией клеток, приводят к выходу трансаминаз из очага поражения в кровь. Так, уже через 3–5 ч после развития инфаркта миокарда уровень АсАТ в сыворотке кровирезко повышается (в 20–30 раз). Максимум активности обеих трансаминаз крови приходится на конец первых суток, а уже через 2–3 дня при благоприятном исходе болезни уровень сывороточных трансаминаз возвращается к норме. Напротив, при затяжном процессе или наступлении повторного инфаркта миокарда наблюдается новый пик повышения активности этих ферментов в крови. Этим объясняется тот факт, что в клинике трансаминазный тест используется не только для постановки диагноза, но и для прогноза и проверки эффективности лечения. При поражениях клеток печени, например при гепатитах, также наблюдается гипертрансаминаземия (за счет преимущественного повышения уровня АлАТ), но она имеет более умеренный и затяжной характер, а повышение активноститрансаминазы в сыворотке крови происходит медленно. При различного рода коронарной недостаточности (стенокардия, пороки сердца и др., кроме инфаркта миокарда) гипертрансаминаземия или не наблюдается, или незначительна. Определение активноститрансаминаз в сыворотке крови при заболеваниях сердца следует отнести к дифференциально-диагностическим лабораторным тестам. Повышение уровня трансаминаз в сыворотке крови отмечено, кроме того, при некоторых заболеваниях мышц, в частности при обширных травмах, гангрене конечностей и прогрессивной мышечной дистрофии.
80. Окислительное дезаминирование аминокислот; глутаматдегидрогеназа. Непрямое дезаминирование аминокислот. Биологическое значение.
Дезаминирование аминокислот - реакция отщепления α-аминогруппы от аминокислоты, в результате чего образуется соответствующая α-кетокислота (безазотистый остаток) и выделяется молекула аммиака. Аммиак токсичен для ЦНС, поэтому в организме человека и млекопитающих он превращается в нетоксичное хорошо растворимое соединение - мочевину. В виде мочевины, а также в виде солей аммония аммиак выводится из организма. Безазотистый остаток используется для образования аминокислот в реакциях трансаминирования, в процессах глюконеогенеза, кето-генеза, в анаплеротических реакциях для восполнения убыли метаболитов ОПК, в реакциях окисления до СО2 и Н2О.
Существует несколько способов дезаминирования аминокислот:
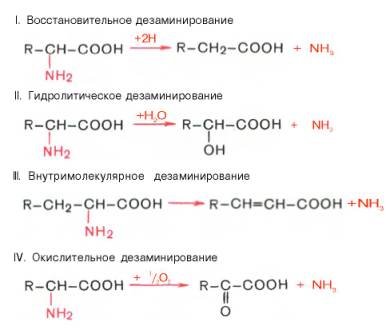
Окислительное дезаминирование. Наиболее активно в тканях происходит дезаминирование глутаминовой кислоты. Реакцию катализирует фермент глутаматдегидрогеназа, коферментом глутаматдегидрогеназы является NAD+. Реакция идёт в 2 этапа. Вначале происходит ферментативное дегидрирование глутамата и образование а-иминоглутарата, затем - неферментативное гидролитическое отщепление иминогруппы в виде аммиака, в результате чего образуется а-кетоглутарат. Окислительное дезаминирование глутамата - обратимая реакция и при повышении концентрации аммиака в клетке может протекать в обратном направлении, как восстановительное шинирование α -кетоглутарата. Глутаматдегидрогеназа очень активна в митохондриях клеток практически всех органов, кроме мышц. Этот фермент - олигомер, состоящий из 6 субъединиц (молекулярная масса 312 кД). Глутаматдегидрогеназа играет важную роль, так как является регуляторным ферментом аминокислотного обмена. Аллостерические ингибиторы глутаматдегидрогеназы (АТФ, ГТФ, NADH) вызывают диссоциацию фермента и потерю глутаматдегидрогеназной активности. Высокие концентрации АДф активируют фермент. Таким образом, низкий энергетический уровень в клетках стимулирует разрушение аминокислот и образованиеα-кетоглутарата, поступающего в ЦТК как энергетический субстрат. Глутаматдегидрогеназа может индуцироваться стероидными гормонами (кортизолом).
Оксидаза L-аминокислот. В печени и почках обнаружен фермент оксидаза L-аминокислот, способный дезаминировать некоторые L-аминокислоты. Коферментом в данной реакции выступает FMN. Однако вклад оксидазы L-аминокислот в дезаминирование, очевидно, незначителен, так как оптимум её действия лежит в щелочной среде (рН 10,0). В клетках, где рН среды близок к нейтральному, активность фермента очень низка.
Оксидаза D-аминокислот также обнаружена в почках и печени. Это FAD-зависимый фермент. Оптимум рН этой оксидазы лежит в нейтральной среде, поэтому фермент более активен, чем оксидаза L-аминокислот. Роль оксидазы D-аминокислот невелика, так как количество D-изомеров в организме крайне мало, потому что в белки пищи и белки тканей человека и животных входят только природные L-аминокислоты. Вероятно, оксидаза D-аминокислот способствует их превращению в соответствующие L-изомеры.
Непрямое дезаминирование (трансдезаминирование) Большинство аминокислот не способно дезаминироваться в одну стадию, подобно Глу. Аминогруппы таких аминокислот в результате трансаминирования переносятся на α-кетоглутарат с образованием глутаминовой кислоты, которая затем подвергается прямому окислительному дезаминированию. Такой механизм дезаминирования аминокислот в 2 стадии получил название трансдезаминирования, или непрямого дезаминирования:
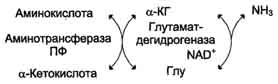
Непрямое дезаминирование аминокислот происходит при участии 2 ферментов: аминотрансферазы (кофермент ПФ) и глутаматдегидрогеназы (кофермент NAD+).
Значение этих реакций в обмене аминокислот очень велико, так как непрямое дезаминирование - основной способ дезаминирования большинства аминокислот. Обе стадии непрямого дезаминирования обратимы, что обеспечивает как катаболизм аминокислот, так и возможность образования практически любой аминокислоты из соответствующей α-кетокислоты.
В мышечной ткани активность глутаматдегидрогеназы низка, поэтому в этих клетках при интенсивной физической нагрузке функционирует ещё один путь непрямого дезаминирования с участием цикла ИМФ-АМФ. Вначале происходит перенос аминогруппы аминокислот на аспартат, затем на инозиновую кислоту (ИМФ) и в завершение - дезаминирование АМФ. Представленная схема отражает последовательность реакций непрямого неокислительного дезаминирования:
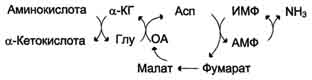
Можно выделить 4 стадии процесса:
- трансаминирование с α-кетоглутаратом, образование глутамата;
- трансаминирование глутамата с оксалоацета-том (фермент ACT), образование аспартата;
- реакция переноса аминогруппы от аспартата на ИМФ (инозинмонофосфат), образование АМФ и фумарата;
- гидролитическое дезаминирование АМФ.
Перенос аминогруппы от аспартата и синтез АМФ происходят следующим образом.
Реакция дезаминирования адениловой кислоты происходит под действием фермента АМФ дезаминазы Этот путь дезаминирования преобладает в мышцах при интенсивной работе, в результате которой накапливается молочная кислота. Выделяющийся аммиак предотвращает закисление среды в клетках, вызванное образованием лактата.
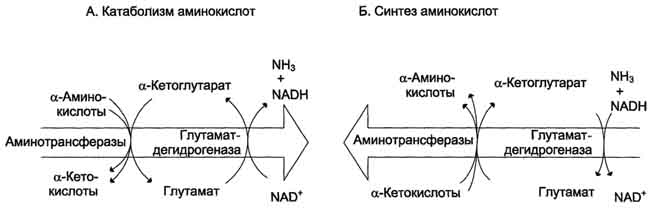
Биологическая роль непрямого дезаминирования. А - при катаболизме почти все природные аминокислоты сначала передают аминогруппу на а-кетоглутарат в реакции трансаминирования с образованием глутамата и соответствующей кетокислоты. Затем глутамат подвергается прямому окислительному дезаминированию под действием глутаматдегидрогена-зы, в результате чего получаются а-кетоглутарат и аммиак; Б - при необходимости синтеза аминокислот и наличии необходимых α-кетокислот обе стадии непрямого дезаминирования протекают в обратном направлении. В результате восстановительного аминирования а-кетоглутарата образуется глутамат, который вступает в трансаминирование с соответствующей α-кетокислотой, что приводит к синтезу новой аминокислоты.
81. Основные источники аммиака в организме. Роль глутамата в обезвреживании и транспорте аммиака. Глутамин как донор амидной группы при синтезе ряда соединений.
Основные источники аммиака
| Источник | Процесс | Ферменты | Локализация процесса |
| Аминокислоты | Непрямое дезаминирование (основной путь дезаминирования аминокислот) | Аминотрансферазы, ПФ Глутаматдегидрогеназа, NAD+ | Все ткани |
| Окислительное дезаминирование глутамата | Глутаматдегидрогеназа, NAD+ | Все ткани | |
| Неокислительное дезаминирование Гис, Сер, Тре | Гистидаза-Серин, треониндегидратазы, ПФ | Преимущественно печень | |
| Окислительное дезаминирование аминокислот (малозначимый путь дезаминирования) | Оксидаза L-аминокислот, FMN | Печень и почки | |
| Биогенные амины | Окислительное дезаминирование (путь инактивации биогенных аминов) | Аминооксидазы, FAD | Все ткани |
| АМФ | Гидролитическое дезаминирование | АМФ-дезаминаза | Интенсивно работающая мышца |
Катаболизм аминокислот в тканях происходит постоянно со скоростью ∼100 г/сут. При этом в результате дезаминирования аминокислот освобождается большое количество аммиака. Значительно меньшие количества его образуются при дезаминировании биогенных аминов и нуклеотидов. Часть аммиака образуется в кишечнике в результате действия бактерий на пищевые белки (гниение белков в кишечнике) и поступает в кровь воротной вены. Концентрация аммиака в крови воротной вены существенно больше, чем в общем кровотоке. В печени задерживается большое количество аммиака, что поддерживает низкое содержание его в крови. Концентрация аммиака в крови в норме редко превышает 0,4-0,7 мг/л (или 25-40 мкмоль/л). В крови и цитозоле клеток при физиологических значениях рН аммиак переходит в ион аммония - NH4+, количество неионизированного NH3 невелико (~ 1%)Высокая интенсивность процессов дезаминирования аминокислот в тканях и очень низкий уровень аммиака в крови свидетельствуют о том, что в клетках активно происходит связывание аммиака с образованием нетоксичных соединений, которые выводятся из организма с мочой. Эти реакции можно считать реакциями обезвреживания аммиака. В разных тканях и органах обнаружено несколько типов таких реакций.Основной реакцией связывания аммиака, протекающей во всех тканях организма, является синтез глутамина под действием глутамин-синтетазы:
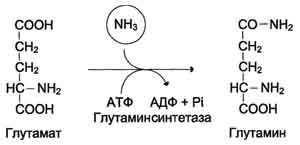
Глутаминсинтетаза локализована в митохондриях клеток, для работы фермента необходим кофактор - ионы Mg2+. Глутаминсинтетаза - один из основных регуляторных ферментов обмена аминокислот и аллостерически ингибируется АМФ, глюкозо-6-фосфатом, а также Гли, Ала и Гис. Глутамин легко транспортируется через клеточные мембраны путём облегчённой диффузии (для глутамата возможен только активный транспорт) и поступает из тканей в кровь. Основными тканями-поставщиками глутамина служат мышцы, мозг и печень. С током крови глутамин транспортируется в кишечник и почки.
В клетках кишечника под действием фермента глутаминазы происходит гидролитическое освобождение амидного азота в виде аммиака:
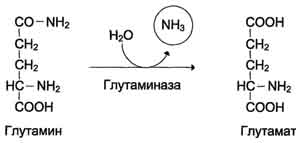
Образовавшийся в реакции глутамат подвергается трансаминированию с пируватом. ос-Аминогруппа глутаминовой кислоты переносится в состав аланина. Большие количества аланина поступают из кишечника в кровь воротной вены и поглощаются печенью. Около 5% образовавшегося аммиака удаляется в составе фекалий, небольшая часть через воротную вену попадает в печень, остальные ~90% выводятся почками.
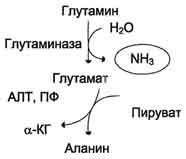
В почках также происходит гидролиз глутамина под действием глутаминазы с образованием аммиака. Этот процесс является одним из механизмов регуляции кислотно щелочного равновесия в организме и сохранения важнейших катионов для поддержания осмотического давления. Глутаминаза почек значительно индуцируется при ацидозе, образующийся аммиак нейтрализует кислые продукты обмена и в виде аммонийных солей экскретируется с мочой. Эта реакция защищает организм от излишней потери ионов Na+ и К+, которые также могут использоваться для выведения анионов и утрачиваться. При алкалозе количество глутаминазы в почках снижается. В почках образуется и выводится около 0,5 г солей аммония в сутки. Высокий уровень глутамина в крови и лёгкость его поступления в клетки обусловливают использование глутамина во многих анаболических процессах.
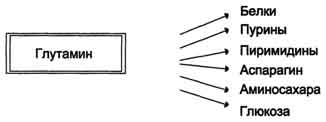
Глутамин - основной донор азота в организме. Амидный азот глутамина используется для синтеза пуриновых и пиримидиновых нуклеотидов, аспарагина, аминосахаров и других соединений
82. Глутаминаза почек; образование и выведение солей аммония. Активация глутаминазы почек при ацидозе.
В почках также происходит гидролиз глутамина под действием глутаминазы с образованием аммиака. Этот процесс является одним из механизмов регуляции кислотно щелочного равновесия в организме и сохранения важнейших катионов для поддержания осмотического давления. Глутаминаза почек значительно индуцируется при ацидозе, образующийся аммиак нейтрализует кислые продукты обмена и в виде аммонийных солей экскретируется с мочой. Эта реакция защищает организм от излишней потери ионов Na+ и К+, которые также могут использоваться для выведения анионов и утрачиваться. При алкалозе количество глутаминазы в почках снижается. В почках образуется и выводится около 0,5 г солей аммония в сутки. Высокий уровень глутамина в крови и лёгкость его поступления в клетки обусловливают использование глутамина во многих анаболических процессах.
83. Биосинтез мочевины. Связь орнитинового цикла с ЦТК. Происхождение атомов азота мочевины. Нарушения синтеза и выведения мочевины. Гипераммонемии.
Мочевина - основной конечный продукт азотистого обмена, в составе которого из организма выделяется до 90% всего выводимого азота. Экскреция мочевины в норме составляет ∼25 г/сут. При повышении количества потребляемых с пищей белков экскреция мочевины увеличивается. Мочевина синтезируется только в печени. Поражение печени и нарушение синтеза мочевины приводят к повышению содержания в крови и тканях аммиака и аминокислот (в первую очередь, глутамина и аланина).
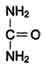
Мочевина (карбамид) - полный амид угольной кислоты - содержит 2 атома азота. Источником одного из них является аммиак, который в печени связывается с диоксидом углерода с образованием карбамоилфосфата под действием карбамоилфосфатсинтетазы I.
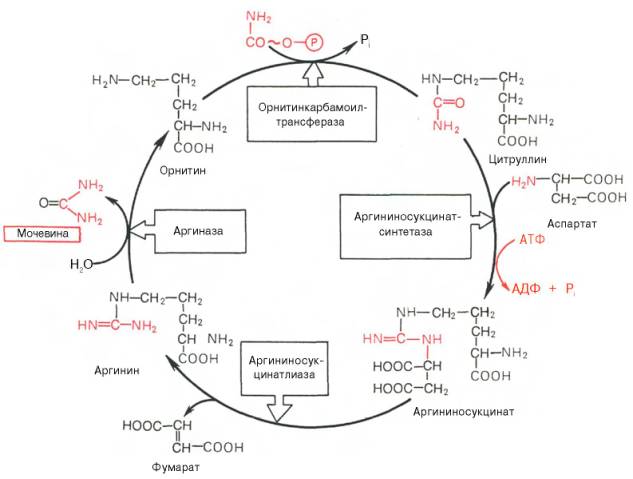
Далее под действием орнитинкарбамоилтрансферазы карбамоильная группа карбамоилфосфата переносится на α-аминокислоту орнитин, и образуется другая α-аминокислота – цитруллин. Следующей реакции аргининосукцинатсинтетаза связывает цитруллин с аспартатом и образует аргининосукцинат (аргининоянтарную кислоту). Этот фермент нуждается в ионах Mg2+. В реакции затрачивается 1 моль АТФ, но используется энергия двух макроэргических связей. Аспартат - источник второго атома азота мочевины Далее фермент аргининосукцинатлиаза (аргининосукциназа) расщепляет аргининосукцинат на аргинин и фумарат, при этом аминогруппа аспартата оказывается в молекуле аргинина. Аргинин подвергается гидролизу под действием аргиназы, при этом образуются орнитин и мочевина. Кофакторами аргиназы являются ионы Са2+ или Мn2+. Высокие концентрации орнитина и лизина, являющихся структурными аналогами аргинина, подавляют активность этого фермента. Образующийся орнитин взаимодействует с новой молекулой карбамоилфосфата, и цикл замыкается. Первые две реакции процесса происходят в митохондриях гепатоцитов. Затем цитруллин, являющийся продуктом этих реакций, транспортируется в цитозоль, где и осуществляются дальнейшие превращения.
Суммарное уравнение синтеза мочевины:
СО2 + NH3 + Аспартат + 3 АТФ + 2 Н2О → Мочевина + Фумарат + 2 (АДФ + Н3Р04) + АМФ + H4P2O7.
Взаимосвязь орнитинового цикла и общего пути катаболизма. Фумарат, образующийся в результате расщепления аргининосукцината, превращается в малат, который затем переносится в митохондрии, включается в ЦТК и дегидрируется с образованием оксалоацетата. Эта реакция сопровождается выделением 3 молекул АТФ, которые и компенсируют затраты энергии на синтез одной молекулы мочевины.
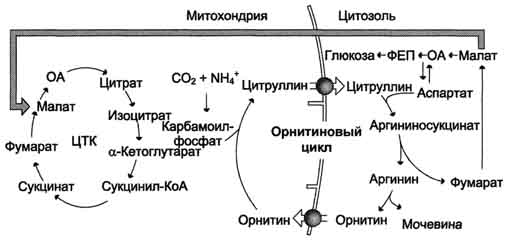
Гипераммониемия Нарушение реакций обезвреживания аммиака может вызвать повышение содержания аммиака в крови - гипераммониемию, что оказывает токсическое действие на организм. Причинами гипераммониемии могут выступать как генетический дефект ферментов орнитинового цикла в печени, так и вторичное поражение печени в результате цирроза, гепатита и других заболеваний. Известны пять наследственных заболеваний, обусловленных дефектом пяти ферментов орнитинового цикла:
Наследственные нарушения орнитинового цикла и основные их проявления
| Заболевание | Дефект фермента | Тип наследования | Клинические проявления | Метаболиты | |
| кровь | моча | ||||
| Гиперам- мониемия, тип I | Карбамоил- фосфат- синтетаза I | Аутосомно- рецессивный | В течение 24-48 ч после рождения кома, смерть | Глн Ала NH3 | Оротат |
| Гиперам- мониемия, тип II | Орнитин- карбамоил- трансфераза | Сцепленный с Х-хромосомой | Гипотония, снижение толерантности к белкам | Глн Ала NH3 | Оротат |
| Цитрул- линемия | Аргинино- сукцинат- синтетаза | Аутосомно- рецессивный | Гипераммониемия тяжёлая у новорождённых. У взрослых - после белковой нагрузки | Цитруллин NH3 | Цитруллин |
| Аргинино- сукцина- турия | Аргинино- сукцинат- лиаза | Аутосомно-рецессивный | Гипераммонимия, атаксия, судороги, выпадение волос | Аргини- носукцинат NH3 | Аргини- носукци- нат, Глн, Ала, Лиз |
| Гиперар- гининемия | Аргиназа | Аутосомно-рецессивный | Гипераргининемия | Apr NH3 | Apr Лиз Орнитин |
Нарушение орнитинового цикла наблюдается при гепатитах различной этиологии и некоторых других вирусных заболеваниях. Например, установлено, что вирусы гриппа и других острых респираторных вирусных инфекций снижают активность карбамоилфосфатсинтетазы I. При циррозе и других заболеваниях печени также часто наблюдают гипераммониемию. Снижение активности какого-либо фермента синтеза мочевины приводит к накоплению в крови субстрата данного фермента и его предшественников. Так, при дефекте аргининосук-цинатсинтетазы повышается содержание цитруллина (цитруллинемия); при дефекте аргиназы - концентрация аргинина, аргининосукцината, цитруллина и т.д. При гипераммониемиях I и II типа вследствие дефекта орнитинкарбамоилтрансферазы происходит накопление карбамоилфосфата в митохондриях и выход его в цитозоль. Это вызывает увеличение скорости синтеза пиримидиновых нуклеотидов (вследствие активации карбамоилфосфатсинтетазы II), что приводит к накоплению оротата, уридина и урацила и выведению их с мочой. Содержание всех метаболитов повышается, и состояние больных ухудшается при увеличении количества белков в пище. Тяжесть течения заболевания зависит также от степени снижения активности ферментов. Все нарушения орнитинового цикла приводят к значительному повышению в крови концентрации аммиака, глутамина и аланина.
Гипераммониемия сопровождается появлением следующих симптомов:
- тошнота, повторяющаяся рвота;
- головокружение, судороги;
- потеря сознания, отёк мозга (в тяжёлых случаях);
- отставание умственного развития (при хронической врождённой форме
· Все симптомы гипераммониемии - проявление действия аммиака на ЦНС (см. выше подраздел IV, Б).
Для диагностики различных типов гипераммониемии производят определение содержания аммиака в крови, метаболитов орнитинового цикла в крови и моче, акгивности фермента в биоптатах печени. Основной диагностический признак - повышение концентрации аммиака в крови. Содержание аммиака в крови может достигать 6000 мкмоль/л (в норме - 60 мкмоль/л). Однако в большинстве хронических случаев уровень аммиака может повышаться только после белковой нагрузки или в течение острых осложнённых заболеваний.
84. Обмен безазотистого остатка аминокислот. Гликогенные и кетогенные аминокислоты. Синтез глюкозы из аминокислот. Синтез аминокислот из глюкозы.
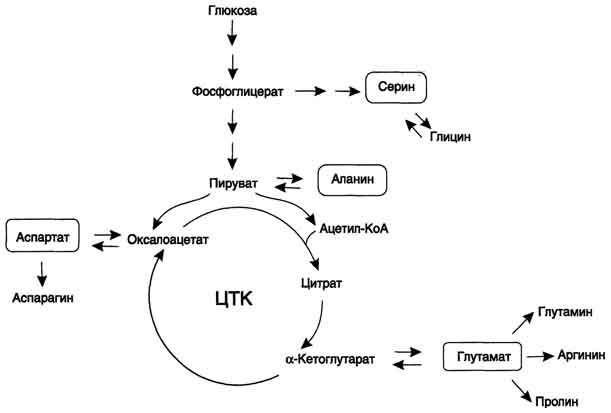
В ходе катаболизма аминокислот происходит отщепление аминогруппы и выделение аммиака. Другим продуктом дезаминирования аминокислот служит их безазотистый остаток в виде α-кетокислот. Катаболизм аминокислот происходит практически постоянно. За сутки в норме в организме человека распадается примерно 100 г аминокислот, и такое же количество должно поступать в составе белков пищи. Большая часть безазотистых остатков аминокислот превращается в пируват либо непосредственно (Ала, Сер), либо в результате более сложного пути, превращаясь вначале в один из метаболитов ЦТК. Затем в реакциях цитратного цикла происходит образование оксалоацетата, который превращается в фосфоенолпируват. Из фосфоенолпирувата под действием пируваткиназы образуется пируват. Пируват подвергается окислительному декарбоксилированию и превращается в ацетил-КоА, который окисляется в ЦТК до СО2 и Н2О с выделением энергии. Такой путь проходят преимущественно аминокислоты пищи. При недостатке глюкозы в организме фосфоенолпируват включается в глюконеогенез. Это происходит при голодании, длительной физической работу при сахарном диабете и других тяжёлых хронических заболеваниях, сопровождающихся распадом собственных белков организма. Скорость глюконеогенеза из аминокислот регулируется гормонами. Так, под действием глюкагона увеличивается активность регуляторных ферментов процесса, а кортизол индуцирует синтез ферментов глюконеогенеза в печени. Активация глюконеогенеза из аминокислот происходит и при преимущественно белковом питании. Катаболизм всех аминокислот сводится к образованию шести веществ, вступающих в общий путь катаболизма: пируват, ацетил-КоА, α -кетоглутарат, сукцинил-КоА, фумарат, оксалоацетат.
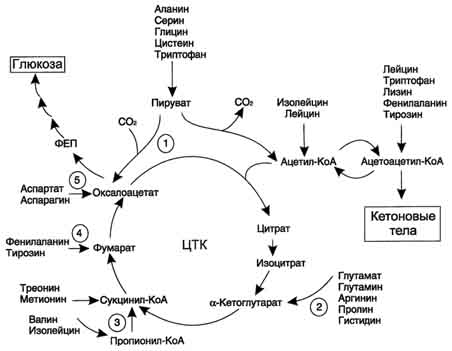
Аминокислоты, которые превращаются в пируват и промежуточные продукты ЦТК (α-КГ, сукцинил-КоА, фумарат) и образуют в конечном итоге оксалоацетат, могут использоваться в процессе глюконеогенеза. Такие аминокислоты относят к группе гликогенных аминокислот.
Некоторые аминокислоты в процессе катаболизма превращаются в ацетоацетат (Лиз, Лей) или ацетил-КоА (Лей) и могут использоваться в синтезе кетоновых тел. Такие аминокислоты называют кетогенными.
Ряд аминокислот используется и для синтеза глюкозы, и для синтеза кетоновых тел, так как в процессе их катаболизма образуются 2 продукта - определённый метаболит цитратного цикла и ацетоацетат (Три, Фен, Тир) или ацетил-КоА (Иле). Такие аминокислоты называют смешанными, или гликокетогенными.
В условиях голодания часть белков мышечной ткани распадается до аминокислот, которые далее включаются в процесс катаболизма. Аминокислоты, которые при катаболизме превращаются в пируват или метаболиты цитратного цикла, могут рассматриваться как потенциальные предшественники глюкозы и гликогена и носят название гликогенных. Например, окса-лоацетат, образующийся из аспарагиновой кислоты, является промежуточным продуктом как цитратногр цикла, так и глюконеогенеза.
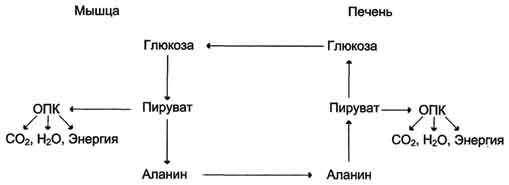
Из всех аминокислот, поступающих в печень, примерно 30% приходится на долю аланина. Это объясняется тем, что при расщеплении мышечных белков образуются аминокислоты, многие из которых превращаются сразу в пируват или сначала в оксалоацетат, а затем в пируват. Последний превращается в аланин, приобретая аминогруппу от других аминокислот. Аланин из мышц переносится кровью в печень, где снова преобразуется в пируват, который частично окисляется и частично включается в глюкозонеогенез. Следовательно, существует следующая последовательность событий (глюкозо-аланиновый цикл): глюкоза в мышцах → пируват в мышцах → аланин в мышцах → аланин в печени → глюкоза в печени → глюкоза в мышцах. Весь цикл не приводит к увеличению количества глюкозы в мышцах, но он решает проблемы транспорта аминного азота из мышц в печень и предотвращает лактоацидоз.
В организме человека возможен синтез восьми заменимых аминокислот: Ала, Асп, Асн, Сер, Гли, Глу, Глн, Про. Углеродный скелет этих аминокислот образуется из глюкозы. α-аминогруппа вводится в соответствующие α-кетокислоты в результате реакций трансаминирования. Универсальным донором α -аминогруппы служит глутамат.
Путём трансаминирования α-кетокислот, образующихся из глюкозы, синтезируются аминокислоты.
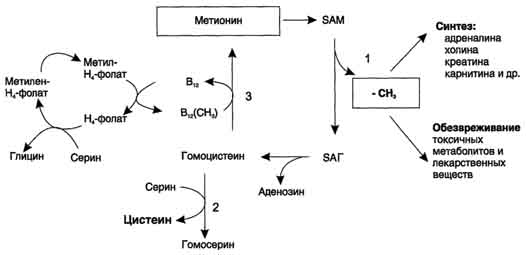
85. Трансметилирование. Метионин и S-аденозилметионин. Синтез креатина, адреналина и фосфатидилхолинов
Метионин - незаменимая аминокислота. Она необходима для синтеза белков организма, участвует в реакциях дезаминирования, является источником атома серы для синтеза цистеина. Метионил-тРНК участвует в инициации процесса трансляции. Метальная группа метионина - мобильный одноуглеродный фрагмент, используемый для синтеза ряда соединений. Перенос метильной группы метионина на соответствующий акцептор называют реакцией трансметилирования, имеющей важное метаболическое значение. Метальная группа в молекуле метионина прочно связана с атомом серы, поэтому непосредственным донором этого одноутлеродного фрагмента служит активная форма аминокислоты.
Реакция активация метионина Активной формой метионина является S-аденозилметионин (SAM) - сульфониевая форма аминокислоты, образующаяся в результате присоединения метионина к молекуле аденозина. Аденозин образуется при гидролизе АТФ. Эту реакцию катализирует фермент метионин аденозилтрансфераза, присутствующий во всех типах клеток. Структура (-S+-CH3) в SAM - нестабильная группировка, определяющая высокую активность метильной группы (отсюда термин "активный метионин"). Эта реакция уникальна для биологических систем, так как, по-видимому, является единственной известной реакцией, в результате которой освобождаются все три фосфатных остатка АТФ. Отщепление метильной группы от SAM и перенос её на соединение-акцептор катализируют ферменты метилтрансферазы. SAM в ходе реакции превращается в S-аденозилгомоцистеин (SAT)
Примеры реакций трансметилирования
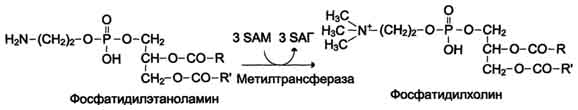
Синтез фосфатидилхолина из фосфатидилэтиноламина
Фосфатидилхолины (лецитины) - наиболее распространённая группа глицерофосфолипидов, участвующих в образовании мембран клеток и липопротеинов, в составе которых осуществляется транспорт липидов
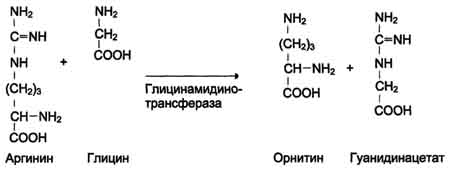
Синтез креатина. Креатин необходим для образования в мышцах высокоэнергетического соединения - кре-атинфосфата. Синтез креатина идёт в 2 стадии с участием 3 аминокислот: аргинина, глицина и метионина. В почках образуется гуанидинацетат при действии глицинамидинотрансферазы
Затем гуанидинацетат транспортируется в печень, где происходит реакция его метилирования
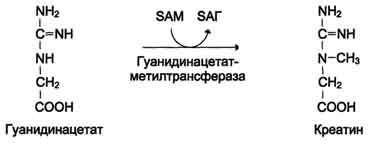
Креатин с кровотоком переносится в мышцы и клетки мозга, где из него образуется высокоэнергетическое соединение - креатинфосфат. Определение содержания креатина и креати-нина в крови и моче используется для характеристики интенсивности работы мышц в спортивной медицине и при некоторых патологических состояниях. Определение активности фермента креатинкиназы и его изоферментных форм в крови используется в медицине для диагностики таких заболеваний, как инфаркт миокарда, миопатии, мышечные дистрофии и др.
Реакции трансметилирования используются также для:
- синтеза адреналина из норадреналина;
- синтеза анзерина из карнозина;
- метилирования азотистых оснований в нук-леотидах и др.;
- инактивации метаболитов (гормонов, медиаторов и др.) и обезвреживания чужеродных соединений, включая и лекарственные препараты.
86. Метилирование ДНК. Представление о метилировании чужеродных и лекарственных соединений.
Метилирование ДНК — это модификация молекулы ДНК без изменения самой нуклеотидной последовательности ДНК, что можно рассматривать как часть эпигенетическойсоставляющей генома. Метилирование ДНК заключается в присоединении метильной группы к цитозину в позиции С5 цитозинового кольца.
У человека за процесс метилирования ДНК отвечают три фермента, называемые ДНК-метилтрансферазами 1, 3a и 3b (DNMT1, DNMT3a, DNMT3b), соответственно. Предполагается, что DNMT3a и DNMT3b — это de novo метилтрансферазы, которые осуществляют формирование паттерна метилирования ДНК на ранних стадиях развития, а также его изменения в процессе дифференцировки клеток. Существует гипотеза о том, что метилирование ДНК de novo вызывается, в частности, интерферирующими РНК при помощи РНК-зависимого метилирования ДНК — процесса, возникшего в ходе эволюции с целью репрессии мобильных элементов генома. DNMT1 является ДНК-метилтрансферазой, которая поддерживает метилированное состояние ДНК, присоединяя метильные группы к одной из цепей ДНК в точках, где другая, комплементарная ей цепь, метилирована. Белок DNMT3L гомологичен другим DNMT-белкам, но не имеет каталитической активности. Вместо этого, DNMT3L поддерживает de novo метилтрансферазы, способствуя связыванию этих ферментов с ДНК и стимулируя их активность.
Метилирование. В организме метилированию могут подвергаться амины, фенолы и тиолы. В результате метилирования образуются соответствующие N-, О- и S-метильные конъюгаты. При метилировании чужеродных соединений и некоторых метаболитов переносчиком метильных групп является кофермент S-аденозилметионин. С участием метильных групп этого кофермента происходит метилирование перечисленных выше соединений. Реакции метилирования происходят под влиянием ферментных систем (метилтрансфераз).
Η-метилирование. При N-метилировании метильная группа S-аденозилметионина под влиянием N-метилтрансферазы присоединяется к атомам азота метаболитов или чужеродных соединений.
О-Метилирование. Этому типу конъюгации подвергаются соединения, содержащие фенольные группы. Под влиянием ферментов (О-метилтрансфераз) метильная группа кофермента S-аденозилметионина присоединяется к атомам кислорода фенольных гидроксилов. Для реакции метилирования фенолов кроме кофермента требуется присутствие ионов магния или ионов других двухвалентных металлов. Соединения, содержащие одну фенольную группу, при наличии указанных ферментов не метилируются.
S- метилирование. Некоторые чужеродные соединения, содержащие тиоловые группы (-SH), в организме подвергаются метилированию. При этом метильная группа кофермента S-аденозилметионина в присутствии ферментов (метилтрансфераз) переносится к атомамсеры метаболитов или чужеродных соединений с образованием соответствующих S-метилпроизводных этих соединений.
87. Источники и образование одноуглеродных групп. Тетрагидрофолиевая кислота и цианкобаламин и их роль в процессах трансметилирования.
Образование и использование одноуглеродных фрагментов. Особое значение реакций катаболизма серина и глицина заключается в том, что они сопровождаются образованием одноуглеродного метиленового фрагмента (-СН2-). Метиленовая группа в молекуле метилен- Н4-фолата может превращаться в другие одноуглеродные группы (фрагменты): метенильную (-СН=), формильную (-НС=О), метильную (-СН3) и формиминогруппу (-CH=NH). Ещё один источник формального и форми-мино-фрагментов - гистидин. Катаболизм гистидина происходит только в печени (очень небольшой процент в коже) в результате следующих реакций
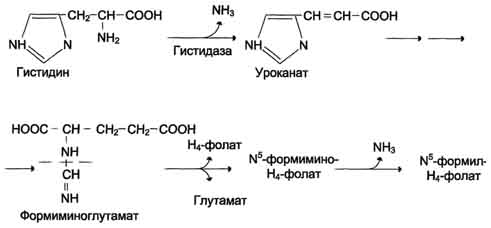
Конечными продуктами катаболизма гистидина являются глутамат, NH3 и одноуглеродные фрагменты - формимино-Н4-фолат и формил-Н4-фолат.
Все образующиеся производные Н4-фолата играют роль промежуточных переносчиков и служат донорами одноуглеродных фрагментов при синтезе некоторых соединений: пуриновых оснований и тимидиловой кислоты (необходимых для синтеза ДНК и РНК), регенерации метионина, синтезе различных формиминопроизводных (формиминоглицина и т.д.)
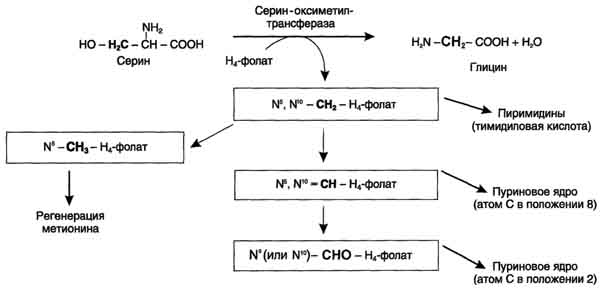
Перенос одноуглеродных фрагментов к акцептору необходим не только для синтеза ряда соединений, но и для регенерации свободного Н4-фолата в печени.
Доказано, что коферментные функции ТГФК непосредственно связаны с переносом одноуглеродных групп, первичными источниками которых в организме являются β-углеродный атом серина, α-углеродный атом глицина, углерод метальных групп метионина, холина, 2-й углеродный атом индольного кольца триптофана, 2-й углеродный атом имидазольного кольца гистидина, а также формальдегид,муравьиная кислота и метанол. К настоящему времени открыто шесть одноуглеродных групп, включающихся в разнообразные биохимические превращения в составе ТГФК: формильная (—СНО), метильная (—СН3), метиленовая (—СН2—), метенильная (—СН=), оксиметильная (—СН2ОН) и формими-новая (—CH=NH). Выяснено, что присоединени
 2015-01-30
2015-01-30 5346
5346
