В ОТК фармацевтического предприятия для оценки качества поступило несколько серий образцов магния сульфата. При его количественном определении по методике ГФ для образцов одной серии был получен результат, показавший, что содержание лекарственного вещества превысило максимально допустимую норму. Дайте обоснование причинам изменения его качества по данному показателю в соответствии со свойствами препарата. Предложите другие испытания, характеризующие его качество.
- Приведите русское, латинское и рациональное название препарата. Охарактеризуйте физико-химические свойства (внешний вид, растворимость, щёлочность или кислотность, потеря в весе при прокаливании) и их использование для оценки качества.
- В соответствии с химическими свойствами предложите реакции идентификации и методы количественного определения. Напишите уравнения реакций.
MgSO4 · 7H2O
Magnesii sulfas
Магния сульфат
Магния сульфат при приеме внутрь действует как слабительное средство, оказывает также желчегонное действие. При парентеральном введении оказывает успокаивающее действие на ЦНС. В зависимости от дозы могут наблюдаться седативный, снотворный эффект.
2.
Описание:
Бесцветные призматические кристаллы, выветривающиеся на воздухе. Горько соленого вкуса.
Растворимость:
Растворим в 1ч воды, 0,3 ч- кипящей воды. Практически не растворим в 95% спирте.
Магния сульфат легко выветривается на воздухе, т.к. теряет кристаллизационную воду уже при комнатной температуре, что обусловлено прочностью связи между веществом и кристаллизационной водой. Сульфат магния растворим в воде, т.к. вещества с ионным типом связи лучше растворяются в полярных растворителях, но в спирте он практически не растворим, это обусловлено затратой значительного количества энергии на разрушение кристаллической решетки твердого тела, что не полностью компенсируется энергией, выделившейся при образовании сольватов.
3.
Подлинность: NH4Cl
1) MgSO4 + Na2HPO4 + NH4OH → MgNH4PO4 ↓ + Na2SO4 + H2O
MgNH4PO4 ↓ - белый кристаллический осадок, растворимый в минеральных кислотах и уксусной кислоте, NH4Cl – предотвращает выделение осадка гидроксида магния.
2) Реакция с 8-оксихинолином (не включена в ГФ 10)
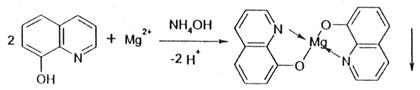
HCl
3) MgSO4 + BaCl2 → BaSO4↓+ MgCl2
BaSO4↓ -белый,нерастворимый в кислотах и щелочах.
4.
Соединения магния количественно определяют прямым комплексонометрическим методом с использованием индикатора кислотного хром черного специального (эриохром черный Т). После добавления индикатора к титруемому раствору ионы магния образуют с ним непрочное комплексное соединение:
Титрант – 0,05 М раствор трилона Б (ЭДТАNa 2 ) связывает находящиеся в растворе ионы магния в комплексное соединение:
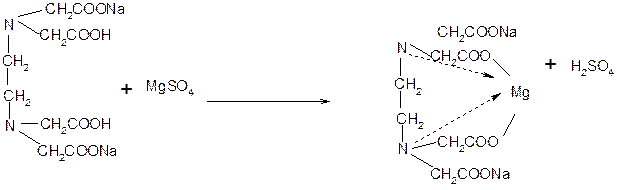
Поскольку при этом происходит выпадение серной кислоты, для поддержания оптимального значения рН среды необходимо прибавлять аммиачный буферный раствор. В эквивалентной точке, когда все ионы магния будут связаны в комплексное соединение металл- ЭДТАNa 2, титрант вступает во взаимодействие с ионами магния, содержащимися в составе комплекса металл-индикатор. Последний имеет меньшую константу устойчивости, чем комплексное соединение индикатор- металл, поэтому происходит разрушение комплекса индикатора с ионами магния. При этом красно-фиолетовая окраска раствора переходит в синюю окраску свободного индикатора.

5.
Инъекционные лекарственные формы - это группа лекарственных форм, вводимых в организм с нарушением целостности кожных покровов и слизистых оболочек с помощью полой иглы и шприца или безыгольным способом под высоким давлением. Согласно ГФ XI к ним относятся стерильные водные и неводные растворы, суспензии, эмульсии и сухие твердые вещества (порошки, пористые массы, таблетки), которые растворяют в стерильном растворителе непосредственно перед введением. Растворы для парентерального применения объемом 100 мл и более относят к инфузионным.
К лекарственным средствам для парентерального применения относятся стерильные водные и неводные растворы, суспензии, эмульсии и сухие твердые вещества (порошки, пористые массы, таблетки), которые растворяют в стерильном растворителе непосредственно перед введением. Растворы для парентерального применения объемом 100 мл и более относятся к инфузионным.
Лекарственные средства для парентерального применения готовят в условиях, максимально предотвращающих загрязнение готового продукта микроорганизмами и посторонними веществами.
Для приготовления лекарственных средств для парентерального применения используют лекарственные, вспомогательные вещества и растворители, разрешенные к медицинскому применению.
Лекарственные средства для парентерального применения должны быть стерильными, практически свободными от видимых механических включений, выдерживать испытания на пирогеннность и токсичность в соответствии с требованиями частных статей.
ГФ 11 предъявляет к растворам для инъекций следующие требования:
1. Стерильность.
2. Стабильность.
3. Отсутствие механических включений (требование чистоты).
4. Апирогенность.
Инъекционные растворы могут быть изотоничными, изогидричными и изоионичными в соответствии с требованиями частных статей.
Растворители.
В качестве растворителей применяют воду для инъекций, жирные масла, этилолеат. В составе комплексного растворителя могут быть использованы спирт этиловый, глицерин, пропиленгликоль, полиэтиленоксид 400, бензилбензоат, бензиловый спирт и другие растворители.
При изготовлении лекарственных средств для парентерального применения могут быть добавлены консерванты, антиоксиданты, стабилизаторы, эмульгаторы, солюбилизаторы и другие вспомогательные вещества, указанные в частных статьях.
В качестве вспомогательных веществ используют аскорбиновую, соляную, винную, лимонную, уксусную кислоты, натрия карбонат, натрия бикарбонат, натр едкий, натрия или калия сульфит, бисульфит или метабисульфит, натрия тиосульфат, натрия цитрат, натрия фосфат одно- и двузамещенный, натрия хлорид, метиловый эфир оксибензойной кислоты, пропиловый эфир оксибензойной кислоты, ронгалит, динатриевую соль этилендиаминтетрауксусной кислоты, спирт поливиниловый, хлоробутанол, крезол, фенол и др.
Количество добавляемых вспомогательных веществ, если нет других указаний в частных статьях, не должно превышать следующих концентраций: для веществ, подобных хлорбутанолу, крезолу, фенолу, — до 0,5 %; сернистого ангидрида или эквивалентных количеств сульфита, бисульфита или метабисульфита калия или натрия — до 0,2 %.
Консерванты применяют в многодозовых лекарственных средствах для парентерального применения, а также в однодозовых препаратах в соответствии с требованиями частных статей.
Лекарственные средства для внутриполостных, внутрисердечных, внутриглазных или других инъекций, имеющих доступ к спинномозговой жидкости, а также при разовой дозе, превышающей 15 мл, не должны содержать консервантов.
Сосуды и укупорочные средства должны обеспечивать герметичность, быть индифферентными к содержимому, сохранять его стабильность при стерилизации, хранении и транспортировании. Марки стекла и других укупорочных средств (резины, пластмассы) должны быть указаны в частных статьях. Сосуды изготавливают из материалов, не затрудняющих визуальный контроль содержимого.
Материал пробки должен быть достаточно прочным и эластичным, чтобы обеспечивать отбор содержимого без удаления пробки и отделения ее частиц и герметизацию сосуда после удаления иглы.
Прозрачность.
Растворы должны быть прозрачными, по сравнению с водой для инъекций или соответствующим растворителем, если нет других указаний в частных статьях.
Окраска. Окраску лекарственных средств для парентерального применения определяют путем сравнения с эталонами цветности в соответствии со статьей «Определение окраски жид костей» или указаниями частных статей.
Объем инъекционных растворов в сосудах должен быть больше номинального.
В сосудах вместимостью до 50 мл наполнение проверяют калиброванным шприцем, в сосудах вместимостью 50 мл и более — калиброванным цилиндром при температуре (20 +-2)°С.
Объем раствора, выбранного из сосуда шприцем, после вы теснения воздуха и заполнения иглы или после выливания в цилиндр не должен быть меньше номинального.
Лекарственные средства для парентерального применения подвергают стерилизации в соответствии с требованиями статьи «Стерилизация> и указаниями частных статей.
Стерильность определяют согласно статье «Испытание на стерильность».
Токсичность проверяют в соответствии со статьей «Испытание на токсичность согласно требованиям и тест-дозам, указанным в частных статьях.
Пирогенность проверяют в соответствии со статьей «Испытание на Пирогенность и согласно тест-дозам, указанным в частных статьях.
Испытанию подлежат все лекарственные средства для парентерального применения при объеме одноразовой дозы 10 мл и более, а также при меньшей дозе, если есть указание в частной статье.
Испытание на механические включения лекарственных средств для парентерального применения проводят по соответствующим инструкциям, утвержденным Министерством здравоохранения СССР.
Определение средней массы сухих лекарственных средств для парентерального применения проводят путем взвешивания порознь 20 предварительно вскрытых сосудов с точностью до 0,001 г. Удаляют содержимое промыванием водой или соответствующим растворителем и сушат при температуре 100—105 °С в течение одного часа. Сосуд и укупорочные средства вновь взвешивают. Рассчитывают среднюю массу 20 сосудов и массу содержимого каждого сосуда.
Отклонение массы содержимого одного сосуда от средней массы указанной в разделе «Состав на одну упаковку», должно соответствовать ГФ 11 и непревышать +-15 %. Если в двух сосудах отклонение превышает допустимое, но не более +-15 %, определение повторяют еще в 40 сосудах, в каждом из которых не должно быть отклонения более допустимого по ГФ 11.
Отклонение средней массы содержимого 20 сосудов не должно превышать 5 % от указанного в частных статьях номинального количества.
Для стерильных сухих лекарственных средств для инъекций и суспензий при массе содержимого сосуда 0,05 г и менее проводят испытание однородности дозирования. Испытанию подвергают содержимое 10 сосудов порознь по методикам количественного определения, указанным в частных статьях. Содержание действующего вещества не должно отклоняться от номинально го более чем на 15 %. Если не более чем в одном сосуде отклонение превышает 15 %, но не более 25 %, проводят дополнительное испытание в 20 сосудах. Отклонения содержания действующего вещества более +-15 % не должно быть ни в одном из 20 сосудов.
Суспензии для парентерального применения после встряхивания не должны расслаиваться в течение не менее 5 минут, если в частных статьях нет других указаний. Суспензия должна свободно проходить в шприц через иглу № 0840, если нет других указаний в частных статьях. Суспензии не вводят в кровеносные и лимфатические сосуды и спинномозговой канал; эмульсии не вводят в спинномозговой канал.
Маркировка.
На каждой ампуле (сосуде) указывают название лекарственного средства, его концентрацию или активность, объем или массу, номер серии.
Хранение. В упаковке, обеспечивающей стабильность препарата в течение указанного в частных статьях срока годности.
 2015-01-30
2015-01-30 5037
5037
