Фармацевтическое предприятие производит таблетки аскорбиновой кислоты 0,1г с глюкозой в контурно-ячеечной упаковки 370. Для определения лекарственных веществ в составе таблеток предложите достоверные реакции идентификации и их количественного определения при их совместном присутствии.
•Приведите химические формулы кислоты аскорбиновой и глюкозы. Охарактеризуйте строение и физико-химические свойства (внешний вид, растворимость, спектральные и оптические характеристики) и их использование для оценки качества.
•Дайте сравнительную оценку химических свойств данных лекарственных веществ и предложите реакции идентификации и методы количественного определения при их совместном присутствии. Напишите уравнения реакций
Acidum ascorbinicum
Кислота аскорбиновая
Vitaminum C
Витамин С
g-лактон 2,3-дегидро-α-гулоновой кислоты
Фармакологическая группа: витаминное средство.
Медицинское применение: для профилактики и лечения цинги, при геморрагических диатезах, носовых, легочных, печеночных, маточных и др. кровотечениях.
Glucosum
Глюкоза
Фармакологическая группа: препарат разных фармакологических групп.
Медицинское применение: изотонический раствор применяют для пополнения организма жидкостью, вместе с тем он является источником ценного питательного материала. Применяется при различных заболеваниях.
2.
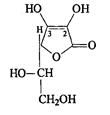
Кислота аскорбиновая относится к группе производных ненасыщенных полиокси-γ-лактонов. По химическому строению кислота аскорбиновая представляет γ-лактон-2,3-дегидро-L-гулоновой кислоты.
Ввиду наличия в молекуле двойной связи возможно существование геометрических цис- и транс-изомеров кислоты аскорбиновой. Однако, пока известен только один из них цис-изомер. Два асимметрических атома углерода обуславливают существование четырех оптических изомеров. Все они получены синтетическим путем только L-изомер является физиологически активным.
Глюкоза.
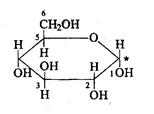
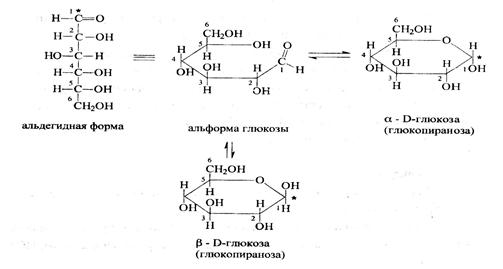
Углевод, представляет собой полиоксикарбонильное соединение, глюкоза является полиоксиальдегидом. Глюкоза - моносахарид. Может существовать в открытой (в ациклической и циклической) форме. Карбонильная группа взаимодействует с одной из гидроксильных групп, образуя циклический полуацеталь.
3.
Описание: белый кристаллический порошок, без запаха, кислого вкуса.
Растворимость: легко растворима в воде, растворима в спирте, практически нерастворима в эфире, бензоле и хлороформе.
Удельное вращение: от + 22° до + 24°. (2% водный раствор)
Температура плавления: 190-193°С (с разложением).
Кислоту аскорбиновую идентифицируют по температуре плавления, удельному вращению, которое обусловлено наличием двух асимметрических атомов углерода (указано выше).
Глюкоза.
Описание: бесцветные кристаллы или белый мелкокристаллический порошок, без запаха, сладкого вкуса.
Растворимость: растворима в 1,5 ч воды, трудно растворима в 95% спирте, практически нерастворима в эфире.
Удельное вращение: от +51,5° до +53°(10% водный раствор). Препарат предварительно сушат при 100-105 °С до постоянного веса. Измерение угла вращения производят после прибавления к раствору препарата 2 капель раствора аммиака.
Потеря в весе при высушивании (за счет кристаллизационной воды) не должна превышать 10%.
Для оценки качества используют оптические свойства глюкозы (удельное вращение). При определении удельного вращения глюкозы необходимо добавление нескольких капель раствора аммиака. При добавлении катализаторов (NH3), а также неорганических и органических кислот увеличивается скорость мутаротации.
Явление мутаротации заключается в следующем:
В свежеприготовленных растворах происходит установление таутомерного равновесия ациклической альдозы с их изомерами, находящимися в пиранозной и фуранозной формах - явление мутаротации.
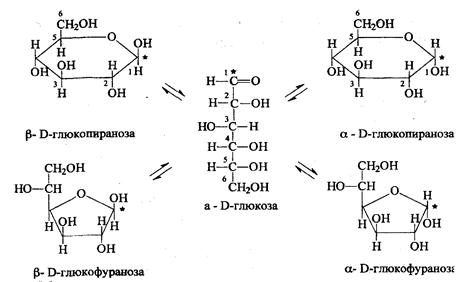
Мутаротация выражается в изменении оптического вращения свежеприготовленных растворов моносахаридов до достижения равновесного значения.
Причина - различие конфигурации ассиметричного углеродного атома, возникающего при циклизации Д-глюкозы. Если проводить определение угла вращения глюкозы сразу после ее растворения и без прибавления к этому раствору аммиака, то величина угла вращения будет равна + 109,16 град и конечного значения + 52,3 град достигнет только через несколько часов.
4.
Химические свойства глюкозы.
Глюкоза- моносахарид. И для нее характерны реакции типичные для альдегидов и для многоатомных спиртов.
1). Как карбонильное соединение вступает в реакции
конденсации по альдегидной группе (например, с фенилгидразином, НСL, тиолами).
2). Как полиоксифенильное соединение вступает в реакции ацилирования, алкилирования, конденсации с альдегидами.
3). Полуацетальный гидроксил обуславливает восстановительные свойства:
-с реактивом Фелинга, Cu2+ → Cu2O
-с [Ag(NH3)2]+→ Ag0
4). Моносахариды гидролизуются до фурфурола и его производных.
5). Оптические свойства моносахаридов определяют характерные константы для препаратов.
1). Подлинность глюкозы устанавливают, нагревая до кипения растворы препаратов с реактивом Фелинга (красный осадок)
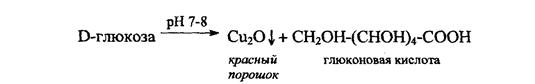
2). Путем взаимодействия глюкозы с аммиачным раствором AgNO3.. При этом выделяется черный осадок Ag0. В присутствии [Ag(NH3)2]+
Д-глюкоза→СН2OH-(CHOH)4-COOH + Ag0
3). Образованием комплексного соединения при взаимодействии
нитрата кобальта Co(NO3)2 и NaOH. При этом появляется фиолетовое окрашивание.
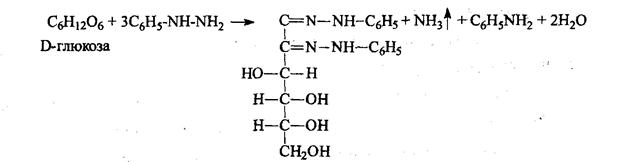
4). Взаимодействием глюкозы с фенилгидразином с образованием кристаллических фенилгидразонов, последующим нагревом на водяной бане и образованием озазонов. Озазоны имеют характерные Тпл.
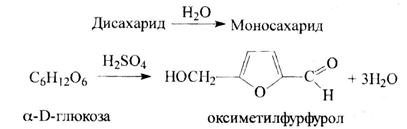
5). Преобразованием глюкозы в оксиметилфурфурол. Реакция основана на получении фурфурола из глюкозы при действии концентрированной серной или соляной кислоты с одновременным взаимодействием фурфурола с каким-либо фенолом или ароматическим амином (резорцином, тимолом, ∆-нафтолом, Е-нафтолом, морфином, фенацетином, нафтиламином и др.)
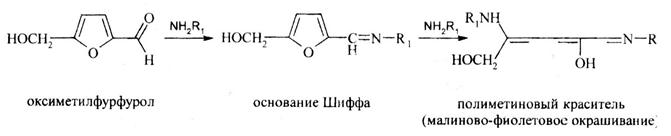
Для фурфурола типичной является реакция получения полиметиновых производных:
6). Взаимодействием моносахаридов с раствором антрона в концентрированной серной кислоте:
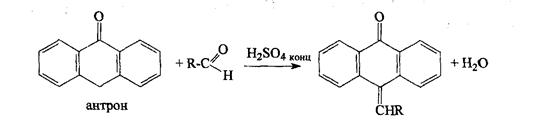
При этом появляется зеленое окрашивание, переходящее в синезеленое.
7). Цветная реакция с 0,5%-ным раствором хлорида трифенилтетразола в присутствии раствора гидроксида натрия с выпадением красного осадка трифенилформазона:
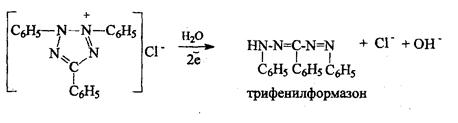
Химические свойства аскорбиновой кислоты.
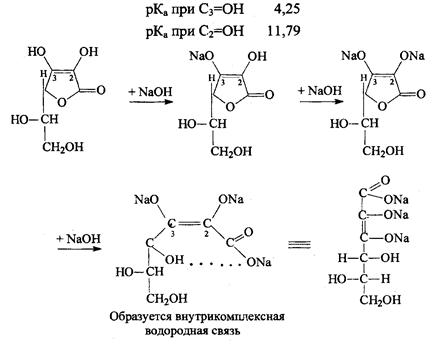
1). Кислотно-основные свойства. Обусловлены ендиольной группировкой аскорбиновой кислоты, а именно подвижностью атомов водорода. При нитровании АК ведет себя как одноосновная кислота, но в сильнощелочных средах она способна образовывать 3-х основную соль.
Обычно протекает только 1 стадия. Действие карбонатов и гидрокарбонатов (СО и НСО аналогично.
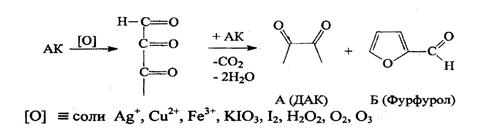
2). Окисление. Подвижность водородных атомов сказывается и на окислении вит. С. Отдавая водород, он превращается в дегидроаскорбиновую кислоту (ДАК). Е = 0,33 В.
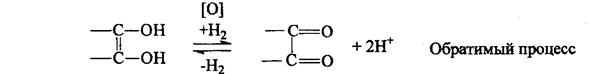
Благодаря обратимости этого процесса аскорбиновая кислота (АК) являет я переносчиком водорода в ферментных системах. При длительном воздействии окислителей образуется 2,3-дикето--L гулоновая кислота.
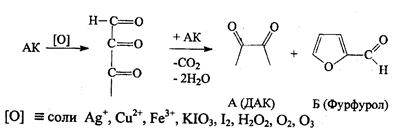
Образование сложных эфиров с высокомолекулярными жирными кислотами при С5 и С6- атомах. Эфиры физиологическим действием не обладают.
Подлинность.
1. Реакция окисления аскорбиновой кислоты. Основана на свойстве АК как сильного восстановителя окисляться до ДАХ, реагент при этом восстанавливается.
а). Реакция серебряного зеркала.
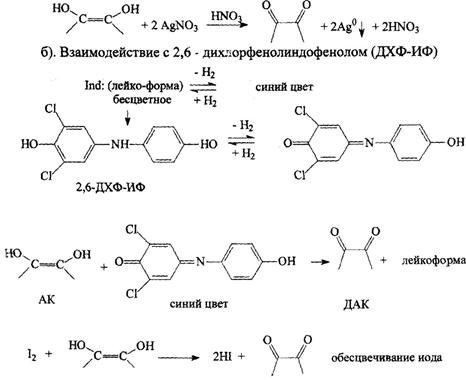
в). Титрование иодом.
г). Реакция с К3Fe(СN)6 и FeCl3 синее окрашивание – берлинская лазурь
д). Реакция с раствором Фелинга.
2). Реакции, основанные на кислотно-основных свойствах аскорбиновой кислоты.


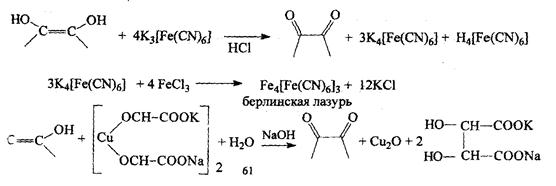
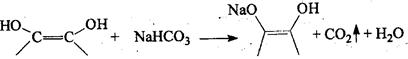
З). На основе физических и физико-химических методов:
температура плавления Т = 190-192° С; удельное вращение [α]20D= + 23°
Количественное определение глюкозы.
Количественное определение препаратов глюкозы НТД не предусмотрено.
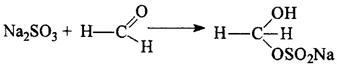
1). Содержание глюкозы определяют йодометрическим методом, основанном на окислении альдегидной группы щелочными растворами иода до образования натриевой соли глюконовой кислоты.
CH2OH(CHOH)4COOH + I2 +3NaOH → CH2OH(CHOH)4COONa + 2NaI + 2H2O
2). С использованием раствора Фелинга. К навеске препарата добавляют точно отмеренное количество раствора, а затем йодометрически устанавливают остаток неизрасходованного на окисление катиона меди (II). По разности вычисляют, сколько получилось восстановленной меди и, соответственно, содержание глюкозы.
3). Поляриметрическим методом определения сахаров, основанным на измерении угла вращения поляризованного луча. Угол вращения ∆ (в градусах), измеряемый на поляриметре, и удельное вращение [∆]20D связаны между собой уравнением:
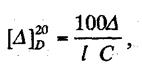
где 1- длина трубки, дм, С - объемная доля, %,∆ - угол вращения
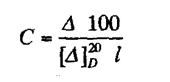
Количественное определение аскорбиновой кислоты.
Количественное определение, основанное на окислительно-восстановительных свойствах аскорбиновой кислоты.
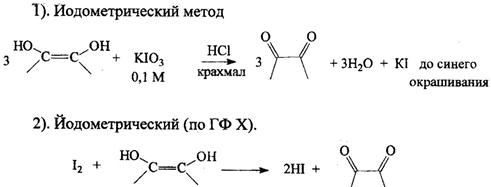
индикатор - крахмал, до появления устойчивого синего окрашивания или без индикатора - до устойчивой желтой окраски.
З). Индофенольный - для определения АК в плодах шиповника (ГФ ХI, МФ). Титруют 2,6 - дихлорфенолиндофенолятом натрия в кислой среде
- образуется бесцветное лейко-основание, титруют до розового окрашивания (избыточная капля титранта в кислой среде).
4). Ферриметрический
Титрант: Fe2(SO4)4 или FeCL3
Среда – Н2SO4 или НСI, соответственно, для подавления гидролиза солей железа.
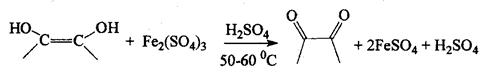
Титрование ведут после нагревания, индикатор - роданид аммония
В точке эквивалентности:
3(NH4)SCN + Fe3+→ Fe(SCN)3 +3 NH4+
красное окрашивание
Метод селективного определения аскорбиновой кислоты в присутствии других восстановителей, например, белков, сахаров, фенольных производных, цистевяа.
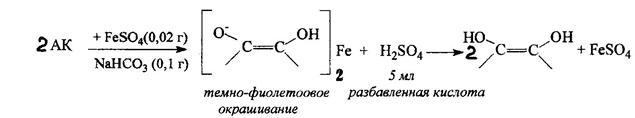
Основанное на реакции кислотного типа. Темно-фиолетовое окрашивание
Алкалиметрический метод нейтрализации - прямое титрование с индикатором - фенолфталеином до розовой окраски.
Используется в многокомпонентной лекарственной форме.
1). Фотоколориметрический, с использованием цветных реакций с
2,б-дихлорфенолиндофенолом, фосфорномолибденовой кислотой - цветные реакции.
2). Спектрофотоколориметрический, исследуют УФ-область:
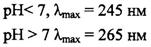
для определения аскорбиновой кислоты Na2S2O3 связывают добавлением формальдегида
Определение глюкозы в данной лекарственной форме по удельному вращению затруднительно, т.к. аскорбиновая кислота тоже является оптически активной. Определение глюкозы в данной лек.форме проводят рефрактометрически. Определяют коэффициент преломления воды(n0) и показатель преломления приготовленного раствора (n)
Mглюк.= [ (n-n0)- Cаск.к-ты * Fаск.к-ты] *5*0,5/ 0,00142*100*0,05
Где F- фактор показателя преломления аскорбиновой кислоты, 0,00142- фактор показателя преломления безводной глюкозы.
5.
Аскорбиновая кислота хранится в хорошо укупоренной таре, предохраняющей от действия света и кислорода воздуха (т.к. аскорбиновая кислота окисляется). Устойчива в кристаллической форме (в отсутствие влаги), она в растворах быстро окисляется.
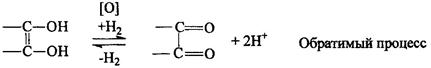
При длительном воздействии окислителей образуется 2,3-дикето-Lгулоновая кислота.
Глюкоза.
Хранится в хорошо укупоренной таре при комнатной температуре. Глюкоза в водных растворах при хранении окисляется.
Д-глюкоза  CH2OH-(CHOH)4-COOH
CH2OH-(CHOH)4-COOH
Глюконовая кислота
Растворы для инъекций необходимо стерилизовать. При стерилизации растворов глюкозы для инъекций происходит окисление, полимеризация и карамелизация глюкозы. При этом наблюдается потемнение, а иногда и побурение растворов. Необходимо добавлять стабилизаторы. Применяют соляную кислоту и хлорид натрия, т.к. при рН=3-4 реакция разложения замедляется. Соляная кислота нейтрализует щелочность стекла. Хлорид натрия смещает равновесие в сторону образования циклической формы глюкозы, которая более устойчивая. Также хлорид натрия образует комплексное соединение по месту альдегидной группы и тем самым предупреждает окислительно-восстановительный процесс.
Применяют два стабилизатора:
1. фармакопейный
NaCl 0,26
0,1M HCl 5 ml
На 1 л раствора глюкозы.
2. аптечный
NaCl 5,2
HCl разб. (8,3%) – 4,4 ml
Воды для инъекций до 1000 ml
Такого стабилизатора берут 5% от объема раствора глюкозы независимо от концентрации.
 2015-01-30
2015-01-30 9291
9291








