Жесткость воды отражает содержание в ней ионов кальция и магния. Жесткость воды выражается в миллимоль эквивалентов ионов Са2+ и Mg2+, содержащихся в 1 л воды (ммоль/л). Один миллимоль эквивалент жесткости отвечает содержанию 20,04 мг/л Са2+ или 12,16 мг/л Mg2+.
Пример 1. Вычислите жесткость воды, зная, что в 500 л ее содержится 202,5 г Са(НСО3)2.
Решение. Так как жесткость выражается числом миллимоль эквивалентов ионов Са2+, содержащихся в 1 л воды (ммоль/л), поэтому необходимо определить массу Ca(HCO3)2 в 1 л воды:
в 500 л воды содержится 202,5 г Ca(HCO3)2
в 1 литре воды содержится х г Ca(HCO3)2
х= 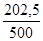 = 0,405г Ca(HCO3)2
= 0,405г Ca(HCO3)2
Рассчитаем, сколько моль эквивалентов составит полученная масса Ca(HCO3)2. Молярная масса эквивалента гидрокарбоната кальция:
M 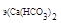 =
= 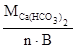 =
= 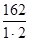 = 81 г/моль,
= 81 г/моль,
где n – число атомов металла,
В – валентность металла.
Составим пропорцию:
масса 1 моль эквивалента Ca(HCO3)2 равна 81г.
масса х моль эквивалента Ca(HCO3)2 равна 0,405г.
Отсюда:
х = 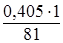 = 0,005 моль эквивалентов, или
= 0,005 моль эквивалентов, или
0,005×1000 =5ммоль эквивалентов Са(НСО3)2 в 1л воды. Следовательно, жесткость воды равна 5 ммоль/л.
Пример 2. Сколько граммов CaSO4 содержится в 1 м3 воды, если жесткость, обусловленная присутствием этой соли, равна 4 ммоль/л?
Решение. Молярная масса сульфата кальция: М 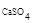 = 136,14 г/моль
= 136,14 г/моль
Молярная масса эквивалента сульфата кальция равна:
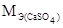 =
= 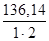 = 68,07 г/моль = 68,07 мг/ммоль
= 68,07 г/моль = 68,07 мг/ммоль
Так как жесткость воды равна 4 ммоль/л, поэтому необходимо определить количество ммоль эквивалентов CaSO4 в 1м3 воды:
1м3 = 1000л, следовательно,
в 1 л воды содержится 4 ммоль эквивалентов CaSO4
в 1000 л воды содержится х моль эквивалентов CaSO4
Отсюда:
х = 4 × 1000 = 4000 ммоль эквивалентов CaSO4
Составим пропорцию:
масса 1 ммоль эквивалента CaSO4 равна 68,07 мг
масса 4000 ммоль эквивалента CaSO4 равна х мг
Следовательно:
х = 68,07 × 4000 = 272280 мг = 272,28 г.
В 1 м3 воды содержится 272,28 г CaSO4.
Пример 3. Какую массу соды надо прибавить к 500 л воды, содержащей хлорид кальция, чтобы устранить ее жесткость, равную 5 ммоль/л.
Решение. Одним из способов устранения жесткости является содовый способ, заключающийся в добавлении к воде соды Na2CO3:
CaCl2 + Na2CO3 = CaCO3¯ + 2NaCl
По закону эквивалентов вещества реагируют в эквивалентных соотношениях, т.е. для устранения жесткости, равной 5 ммоль/л, необходимо к 1л воды прибавить тоже 5 ммоль эквивалентов соды Na2CO3.
К 500л воды соответственно необходимо прибавить 5×500=2500 ммоль эквивалентов соды Na2CO3.
Так как молярная масса эквивалента соды равна:
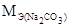 =
= 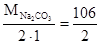 = 53 г/моль, или 53 мг/ммоль, то масса соды, необходимая для устранения жесткости равна:
= 53 г/моль, или 53 мг/ммоль, то масса соды, необходимая для устранения жесткости равна:
53 × 2500 = 132500 мг = 132,5 г соды
Пример 4. Вычислите карбонатную жесткость воды, зная, что на титрование 100 мл этой воды, содержащей гидрокарбонат кальция Ca(HCO3)2, потребовалось 6,25 мл 0,08 н. раствора хлороводородной кислоты.
Решение. Метод титрования применяется в количественном анализе для определения объема раствора известной концентрации, необходимого для определения объёма анализируемого раствора. Для растворов с молярной концентрацией эквивалентов существует следующая зависимость:
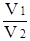 =
= 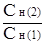 или V1 × Cн (1) =V2 × Cн (2) ,
или V1 × Cн (1) =V2 × Cн (2) ,
т.е. объёмы растворов реагирующих веществ обратно пропорциональны их молярным концентрациям эквивалентов.
Обозначим 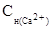 – молярная концентрация эквивалентов ионов кальция, обуславливающих жесткость.
– молярная концентрация эквивалентов ионов кальция, обуславливающих жесткость.
Составим пропорцию:
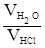 =
= 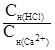 ;
; 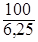 =
= 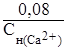 ,
,
отсюда:
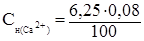 = 0,005 н.
= 0,005 н.
Следовательно, в 1л исследуемой воды содержится 0,005 моль эквивалентов или 0,005 × 1000 = 5 ммоль эквивалентов ионов Ca2+, т.е. карбонатная жесткость воды 5 ммоль/л.
ЗАДАНИЯ
341.Какую массу ортофосфата натрия надо прибавить к 500 л воды, чтобы устранить ее карбонатную жесткость, равную 5 ммоль/л?
342.Какие соли обуславливают жесткость природной воды? Какую жесткость называют карбонатной (временной), некарбонатной (постоянной)? Как можно устранить карбонатную, некарбонатную жесткость? Напишите уравнения соответствующих реакций.
343.Вычислите карбонатную жесткость воды, зная, что для реакции с гидрокарбонатом кальция, содержащимся в 200 мл воды, требуется 15 мл 0,08 н. раствора хлороводородной кислоты.
344.В 1 л воды содержится ионов магния 36,47 мг и ионов кальция 50,1 мг. Чему равна жесткость этой воды?
345.Какую массу карбоната натрия надо прибавить к 400 л воды, чтобы устранить жесткость, равную 3 ммоль/л?
346.Вода, содержащая только сульфат магния имеет жесткость
7 ммоль/л. Какая масса сульфата магния содержится в 300 л этой воды?
347.Вычислите жесткость воды, зная, что в 600 л ее содержится
65,7 г гидрокарбоната магния и 61,2 г сульфата кальция.
348.В 20 л воды содержится 11 г сульфата магния. Чему равна жесткость этой воды?
349.Жесткость воды, в которой растворен только гидрокарбонат кальция, равна 4 ммоль/л. Какой объем 0,1 н. раствора хлороводородной кислоты потребуется для реакции с гидрокарбонатом кальция, содержащимся в 75 мл этой воды?
350.В 1 м3 воды содержится 140 г сульфата магния. Вычислите жесткость этой воды.
351. Вода, содержащая только гидрокарбонат магния, имеет жесткость 3,5 ммоль/л. Какая масса гидрокарбоната магния содержится в 200 л этой воды?
352.Чему равна жесткость воды, если для её устранения к 1м3 воды потребовалось прибавить 132,5г карбоната натрия?
353.Чему равна жесткость воды, если для ее устранения к 50 л воды потребовалось прибавить 21,2 г ортофосфата натрия?
354.Какая масса сульфата кальция содержится в 200 л воды, если жесткость, обуславливаемая этой солью, равна 8 ммоль/л?
355.Вода, содержащая только гидрокарбонат кальция, имеет жесткость 9 ммоль/л. Какая масса гидрокарбоната кальция содержится в 500 л воды?
356.Какую массу гидроксида кальция надо прибавить к 2,5 л воды, чтобы устранить ее жесткость, равную 4 ммоль/л?
357.Какую массу карбоната натрия надо прибавить к 0,1 м3 воды, чтобы устранить жесткость, равную 4 ммоль/л?
358.Чему равна жесткость воды, если для её устранения к 100 л воды потребовалось прибавить 12,95 г гидроксида кальция?
359.Чему равна карбонатная жесткость, если в 1 л ее содержится 0,292 г гидрокарбоната магния и 0,2025 г гидрокарбоната кальция?
360.Какую массу гидроксида кальция надо прибавить к 275 л воды, чтобы устранить ее карбонатную жесткость, равную 5,5 ммоль/л?
р-элементы (…ns2np1-6)*
361.Составьте уравнения реакций, которые нужно провести для осуществления следующих превращений:
Al ® Al2(SO4)3 ® Al(OH)3 ® Na[Al(OH)4] ® Al(NO3)3.
Для окислительно-восстановительной реакции составьте электронные уравнения.
362.Составьте электронные и молекулярные уравнения реакции взаимодействия: а) алюминия с раствором щелочи; б) бора с концентрированной азотной кислотой.
363.Составьте уравнения реакций, которые нужно провести для осуществления следующих превращений: В ® H3BO3 ® Na2B4O7 ® H3BO3
Уравнение окислительно-восстановительной реакции составьте на основании электронных уравнений.
364.С какой степенью окисления олово и свинец образуют устойчивые соединения? Составьте электронные и молекулярные уравнения реакций взаимодействия олова и свинца с концентрированной азотной кислотой.
365.Чем можно объяснить восстановительные свойства соединений олова (II) и окислительные – свинца (IV)? На основании электронных уравнений составьте уравнения реакций взаимодействия: а) хлорида олова (II) с хлоридом ртути (II); б) оксида свинца (IV) с концентрированной хлороводородной кислотой.
366.Какие оксиды и гидроксиды образуют олово и свинец? Как изменяются их окислительно-восстановительные свойства в зависимости от степени окисления элементов? Составьте молекулярные и ионно-молекулярные уравнения реакций взаимодействия раствора гидроксида натрия: а) с оловом; б) с гидроксидом свинца (II).
367.Какие соединения называются карбидами и силицидами? Напишите уравнения реакций взаимодействия: а) карбида алюминия с водой; б) силицида магния с хлороводородной кислотой. Являются ли эти реакции окислительно-восстановительными? Почему?
368.Какие свойства в окислительно-восстановительных реакциях проявляет сернистая кислота? Почему? Напишите электронные и молекулярные уравнения реакций взаимодействия сернистой кислоты: а) с хлорной водой; б) с сероводородом. Укажите окислитель и восстановитель.
_______________________________________________________________
* Общая электронная формула, где n-главное квантовое число
369.Назовите аллотропические модификации фосфора. На основании электронных уравнений составьте уравнение реакции взаимодействия фосфора с азотной кислотой, учитывая, что фосфор окисляется максимально, а азот восстанавливается минимально.
370. Соли какой кислоты называются нитритами? Какова их растворимость в воде? Напишите уравнения реакций взаимодействия нитрита калия: а) с разбавленной серной кислотой; б) с иодидом калия в присутствии серной кислоты; в) с перманганатом калия в присутствии серной кислоты. Для окислительно-восстановительных реакций составьте электронные уравнения. Объясните окислительно-восстановительную двойственность нитритов.
371.Как проявляет себя сероводород в окислительно-восстановительных реакциях? Почему? Составьте электронные и молекулярные уравнения реакций взаимодействия раствора сероводорода: а) с хлором; б) с кислородом.
372.Какие свойства в окислительно-восстановительных реакциях проявляет серная кислота? Напишите молекулярные и электронные уравнения реакций взаимодействия разбавленной серной кислоты с магнием и концентрированной серной кислоты с медью. Укажите окислитель и восстановитель.
373. Составьте молекулярные и электронные уравнения реакций получения оксида серы (IV) из серы, сероводорода, сульфита натрия, концентрированной серной кислоты.
374.Почему азотистая кислота может проявлять как окислительные, так и восстановительные свойства? На основании электронных уравнений составьте уравнения реакций взаимодействия азотистой кислоты: а) с бромной водой; б) с йодоводородом.
375.В каком газообразном соединении азот проявляет свою низшую степень окисления? Напишите уравнения реакций получения этого соединения: а) при взаимодействии хлорида аммония с гидроксидом кальция; б) разложением нитрида магния водой.
376.Приведите примеры реакций, характерных для аммиака: а)замещения атомов водорода, б)образования соединений за счет донорно-акцепторного взаимодействия, в)окисления. Для окислительно-восстановительных реакций составьте электронные уравнения.
377.Покажите три типа термического разложения нитратов на примерах разложения солей: а) нитрата калия; б) нитрата меди (II); в) нитрата серебра(I).
378.Как влияет концентрация азотной кислоты на степень ее восстановления металлами? Имеет ли при этом значение активность металла? Напишите электронные и молекулярные уравнения реакций, взаимодействия концентрированной и разбавленной азотной кислоты: а) с кальцием, б) с серебром, в) с серой.
379.В каком газообразном соединении фосфор проявляет свою низшую степень окисления? Напишите электронные и молекулярные уравнения реакций: а) получения этого соединения при взаимодействии фосфида кальция с соляной кислотой, б) горения фосфина в кислороде.
380.На основании электронных уравнений составьте уравнения реакций взаимодействия висмута с концентрированной серной и разбавленной азотной кислотами.
381.Какую степень окисления проявляет мышьяк, сурьма и висмут? Составьте электронные и молекулярные уравнения реакций взаимодействия: а) мышьяка с концентрированной азотной кислотой, б) висмута с концентрированной серной кислотой, в) сурьмы с разбавленной азотной кислотой.
382.Составьте электронные и молекулярные уравнения реакций, протекающих при пропускании хлора: а) через холодный раствор гидроксида калия; б) через горячий раствор гидроксида калия.
383.Какие реакции нужно провести для осуществления следующих превращений: BaCl2 ® HCl ® Cl2 ® KClO3. Уравнения окислительно-восстановительных реакций составьте на основании электронных уравнений.
384. К растворам солей SbCl3 и BiCl3 добавили раствор гидроксида натрия. К образовавшимся осадкам добавили избыток гидроксида натрия. Объясните, почему осадок растворился только в одном случае. Напишите молекулярные и ионно-молекулярные уравнения происходящих реакций.
385.Чем существенно отличается действие разбавленной азотной кислоты на металлы от действия соляной и разбавленной серной кислот? Что является ионом-окислителем в первом случае, что – в двух других. Напишите электронные и молекулярные уравнения реакций взаимодействия этих кислот с магнием.
386.Напишите формулы и назовите кислородсодержащие кислоты хлора, укажите степень окисления хлора в каждой из них. Какая из этих кислот более сильный окислитель? Составьте уравнение реакции разложения KСlO3 при нагревании: а) в присутствии катализатора; б) без катализатора.
387.Какую степень окисления может проявлять кремний в своих соединениях? Составьте уравнения реакций, которые надо провести для осуществления следующих превращений:
SiO2 ® SiH4 ® SiO2 ® K2SiO3.
При каких превращениях происходят окислительно-восстановительные реакции? Составьте электронные уравнения этих реакций.
388.Какое применение находит кремний? Составьте уравнения реакций, которые надо провести для осуществления следующих превращений:
SiН4 ® Si ® K2SiO3 ® H2SiO3.
Окислительно-восстановительные реакции напишите на основании электронных уравнений.
389.Как получают оксид углерода (IV) в промышленности и в лаборатории? Напишите молекулярные и ионно-молекулярные уравнения соответствующих реакций, при помощи которых можно осуществить следующие превращения:
Са(НСО3)2 ® СО2 ® СаСО3 ® Са(НСО3)2.
390.Какие из солей угольной кислоты имеют наибольшее практическое значение? Как получают в промышленности карбонат и гидрокарбонат натрия? Напишите уравнения соответствующих реакций
391.Какие соединения кальция применяются в производстве строительных материалов? Какими физическими и химическими свойствами этих соединений обусловлено их применение?
392.Какие соединения магния применяются в строительстве? Составьте уравнение реакции получения магнезиального цемента. Опишите процесс его затвердевания. Где его используют?
393.Какие соединения называют негашеной и гашеной известью. Составьте уравнения реакций их получения. Опишите процесс затвердевания извести и составьте уравнение протекающей реакции.
394.При пропускании оксида углерода (IV) через известковую воду образуется осадок, который при дальнейшем пропускании СО2 растворяется. Дайте объяснение этому явлению. Составьте уравнения протекающих процессов. Какова биологическая роль гидрокарбоната кальция?
395.Что представляют собой силикатные стекла? Укажите их состав. Выразите уравнениями реакций технологический процесс получения обыкновенного стекла. Как влияет состав сырьевых материалов на свойства стекла?
396.Как можно получить растворимые силикаты? Напишите уравнения соответствующих реакций. Что такое растворимое стекло? Какую реакцию среды имеет водный раствор растворимого стекла? Напишите ионно-молекулярное и молекулярное уравнения реакции гидролиза силиката натрия. Что такое жидкое стекло и где оно применяется?
397.Приведите формулы некоторых простых и сложных природных силикатов. Укажите их свойства и области использования. Составьте уравнения реакций получения растворимых силикатов.
398.Какие соединения называются алюмосиликатами? Укажите состав полевых шпатов и слюды. Составьте уравнение реакции разложения ортоклаза.
399.Что представляет собой стеклянное волокно и стеклопластики? Где они применяются? Что такое ситаллы? Какими свойствами они обладают?
400.Что называют керамикой? Укажите области ее использования. Опишите процесс изготовления керамических изделий. Составьте уравнение реакции, протекающей при обжиге глины.
401.Из какого сырья получается силикатный цемент? Укажите его химический состав. Опишите процесс затвердевания цемента. Напишите уравнения протекающих реакций.
402.Составьте уравнения реакций, протекающих по следующей схеме:
SiO2 ® SiF4 ® H2SiF6 ® MgSiF6.
Как называются соли гексафторокремниевой кислоты H2SiF6? Какова растворимость этих солей в воде? Где применяются эти соли?
403.Напишите уравнение реакции получения карбида кремния. Какое его техническое название? Какими свойствами он обладает и где используется?
404.Укажите основные различия свойств кристаллического и аморфного оксида кремния (IV) и области их применения. Напишите уравнения реакций взаимодействия оксида кремния (IV) с фтороводородом, гидроксидом натрия, карбонатом натрия. Как используются эти реакции в промышленности?
405.Напишите уравнения реакций, протекающих по схеме:
SiO2 ® Na2SiO3 ® H2SiO3.
Какими свойствами обладают кремниевые кислоты. Что такое золь, гель. Укажите области использования растворимых силикатов.
406.Напишите уравнения реакций, протекающих по схеме:
СаСО3 ® СаО ® Са(ОН)2 ® СаСО3.
Опишите свойства данных соединений. Где на практике используются эти химические процессы?
407. В виде каких модификаций встречается в природе оксид
кремния (IV) (кремнезем)? Дайте их характеристику, укажите, где они применяются. Напишите уравнения соответствующих реакций, при помощи которых можно осуществить следующие превращения:
SiO2 ® Mg2Si ® SiH4 ® SiO2
408.В виде каких природных соединений встречается в природе магний? Напишите реакцию получения оксида магния из магнезита. Какие свойства оксида магния позволяют применять его для получения огнеупорных материалов? Что такое магнезиальный цемент?
409.В виде какого соединения встречается в природе сульфат кальция? Напишите реакцию получения строительного гипса из природного, укажите области его применения.
410.Назовите аллотропические модификации углерода. Чем отличаются они по свойствам? Объясните различие кристаллических структур этих модификаций. Напишите уравнения соответствующих реакций, при помощи которых можно осуществить следующие превращения:
С ® СО2 ® СаСО3 ®СаО ® Са(ОН) 2 .
d – элементы (…(n-1)d1-10ns0-2)*
ЗАДАНИЯ
411.Серебро не взаимодействует с разбавленной серной кислотой, тогда как в концентрированной оно растворяется. Чем это можно объяснить? Составьте электронные и молекулярные уравнения реакций взаимодействия серебра: а) с концентрированной серной кислотой; б) с разбавленной азотной кислотой.
412.Составьте уравнения реакций, которые необходимо провести для осуществления следующих превращений:
Cu ® Cu(NO3)2 ® Cu(OH)2 ® CuSO4 ® [Cu(NH3)4]SO4.
________________________________________________________________
*Общая электронная формула, где n – главное квантовое число
Для окислительно-восстановительной реакции составьте электронные уравнения.
413.Составьте электронные и молекулярные уравнения реакций взаимодействия цинка: а) с раствором гидроксида натрия; б) с концентрированной серной кислотой, учитывая восстановление серы до нулевой степени окисления.
414.Составьте уравнения реакций, которые надо провести для осуществления следующих превращений:
Ag ® AgNO3 ® AgCl ® [Ag(NH3)2]Cl.
Для окислительно-восстановительной реакции составьте электронные уравнения.
415.При постепенном прибавлении раствора иодида калия к раствору нитрата ртути (II) образующийся вначале осадок растворяется. Какое комплексное соединение при этом получается? Составьте молекулярные и ионно-молекулярное уравнения соответствующих реакций.
416.Уравнениями окислительно-восстановительных реакций покажите отношение: а) меди к концентрированной азотной кислоте; б) меди к концентрированной и разбавленной серной кислоте; в) серебра к разбавленной азотной кислоте.
417. Составьте электронные и молекулярные уравнения реакций: а) растворение меди в хлороводородной кислоте с участием кислорода воздуха; б) растворение серебра в концентрированной азотной кислоте; в) растворение меди в разбавленной азотной кислоте.
418.Какую степень окисления проявляют медь, серебро и золото в соединениях? Какая степень окисления наиболее характерна для каждого из них? Какого состава осадок выпадает при добавлении щелочи к раствору AgNO3? Какое соединение получается при растворении Cu(OH)2 в концентрированном растворе гидроксида натрия. Напишите уравнения реакций в молекулярном и ионно-молекулярном виде.
419.Напишите молекулярные и ионно-молекулярные уравнения реакций взаимодействия гидроксида натрия с растворами солей ZnCl2, CdCl2 и HgCl2. Объясните, почему с солью ртути получается оксид, а не гидроксид. Что произойдет, если на полученные осадки гидроксидов подействовать избытком щелочи? Составьте уравнения соответствующих реакций.
420. При действии на титан концентрированной хлороводородной кислоты образуется хлорид титана (III), а при действии азотной – осадок метатитановой кислоты. Составьте электронные и молекулярные уравнения соответствующих реакций.
421.При растворении титана в концентрированной серной кислоте последняя восстанавливается минимально, а титан переходит в катион с максимальной степенью окисления. Составьте электронное и молекулярное уравнение реакции.
422.Оксиды титана (IV) и циркония (IV) при сплавлении взаимодействуют со щелочами. О каких свойствах оксидов говорят эти реакции? Напишите уравнения реакций между: а) TiO2 и BaO; б) ZrO2 и NaOH. В первой реакции образуется метатитанат, а во второй – ортоцирконат соответствующих металлов.
423.На гидроксиды цинка и кадмия подействовали избытком растворов серной кислоты и гидроксида натрия. Какие соединения цинка и кадмия образуются в каждом из этих случаев? Составьте молекулярные и ионно-молекулярные уравнения реакций.
424.Золото растворяется в «царской водке» и в концентрированной селеновой кислоте, приобретая при этом максимальную степень окисления. Составьте электронные и молекулярные уравнения соответствующих реакций, учитывая, что селеновая кислота восстанавливается до оксида селена (IV).
425.Какие металлы входят в состав латуни. Кусок латуни обработали разбавленной азотной кислотой. К полученному раствору солей прибавили избыток раствора гидроксида натрия. Какие соединения цинка и меди образуются при этом? Составьте уравнения соответствующих реакций. Для окислительно-восстановительных реакций составьте электронные уравнения.
426.Ванадий получают алюмотермически или кальцийметрически восстановлением оксида ванадия (V). Последний легко растворяется в щелочах с образованием метаванадатов. Напишите уравнения соответствующих реакций. Уравнения окислительно-восстановительных реакций составьте на основании электронных уравнений.
427.Азотная кислота окисляет цинк до нитрата цинка, а ванадий до метаванадиевой кислоты. Составьте электронные и молекулярные уравнения реакций.
428.Какую степень окисления проявляет ванадий в соединениях? Составьте формулы оксидов ванадия, отвечающих этим степеням окисления. Как меняются кислотно-основные свойства оксидов ванадия при переходе от низшей к высшей степени окисления. Составьте уравнения реакций: а) оксида ванадия (III) с серной кислотой; б) оксида ванадия (V) со щелочью.
429. Докажите способность соединений меди (II), серебра (I) и цинка образовывать комплексные соли. Ответ подтвердите уравнениями реакций взаимодействия соединений этих металлов с водным раствором аммиака.
430.Хромит калия окисляется бромом в щелочной среде. Зеленая окраска раствора переходит в желтую. Составьте электронные и молекулярное уравнения реакции. При подкислении полученного раствора серной кислотой желтая окраска переходит в оранжевую. Объясните это превращение и напишите уравнение протекающей реакции в молекулярной и ионно-молекулярной форме.
431.Назовите природные соединения молибдена и вольфрама. Где применяются эти металлы и их соединения? Составьте электронные и молекулярные уравнения реакций: а) растворения молибдена в азотной кислоте; б) окисления вольфрама на воздухе, учитывая, что молибден и вольфрам приобретают высшую степень окисления.
432.Назовите природные соединения хрома. Где применяется хром и его соединения? Хром получают алюмотермически из оксида хрома (III), а вольфрам – восстановлением оксида вольфрама (VI) водородом. Составьте электронные и молекулярные уравнения соответствующих реакций.
433.Составьте уравнения реакций, которые надо провести для осуществления превращений:
NaCrO2 ® Na2CrO4 ® Na2Cr2O7 ® CrCl3 ® Cr(OH)3 ® Na3[Cr(OH)6]
Уравнения окислительно-восстановительных реакций напишите на основании электронных уравнений.
434.Соствьте уравнения реакций, которые необходимо провести для осуществления превращений:
(NH4)2Cr2O7 ® Cr2O3 ® K2CrO4 ® K2Cr2O7 ® Cr2(SO4)3 ® Cr.
Уравнения окислительно-восстановительных реакций напишите на основании электронных уравнений.
435.Напишите уравнения реакций, которые можно использовать для получения: а) CrO3 из Na2Cr2O7; б) K2CrO4 из Cr2O3; в) K2CrO4 из K3[Cr(OH)6]. Для окислительно-восстановительных реакций составьте электронные уравнения.
436.Марганец азотной кислотой окисляется до низшей степени окисления, а рений приобретает высшую степень окисления. Какие соединения при этом получаются? Составьте электронные и молекулярные уравнения соответствующих реакций.
437.Хлор окисляет манганат калия. Какое соединение при этом получается? Как меняется окраска раствора в результате этой реакции? Что произойдет, если полученный раствор подкислить и добавить раствор сульфита калия. Составьте электронные и молекулярные уравнения реакций.
438.Как меняется степень окисления марганца при восстановлении перманганата калия в кислой, нейтральной и щелочной средах? Составьте электронные и молекулярные уравнения реакций между перманганатом калия и нитритом калия в кислой, нейтральной и щелочной средах.
439.На основании электронных уравнений составьте уравнение реакции получения манганата калия сплавлением оксида марганца (IV) с карбонатом и нитратом калия. Как идет реакция разложения манганата калия водой? Составьте уравнение протекающей при этом реакции.
440.Как можно из перманганата калия получить оксид марганца(VII)? Составьте уравнение протекающей реакции. Напишите уравнения реакций взаимодействия оксида марганца (VII) со щелочью и разложение этого оксида при нагревании.
441.Почему оксид марганца (IV) может проявлять и окислительные, и восстановительные свойства? Исходя из электронных уравнений, составьте уравнения реакций: а) MnO2 + HCl ®;
б) MnO2 + KNO3 + K2CO3 ®.
442.Напишите электронные и молекулярные уравнения реакций, которые можно использовать для получения: а) KMnO4 из K2MnO4; б) MnO2 из KMnO4; в) Mn(NO3)2 из Mn.
443.Как в лаборатории используют перманганат калия для получения кислорода? Составьте уравнение реакции. Предложите способы превращения полученных соединений марганца снова в перманганат калия. Напишите электронные и молекулярные уравнения реакций.
444.Для получения хлора в лаборатории смешивают оксид
марганца (IV) с концентрированной хлороводородной кислотой. Составьте электронные и молекулярные уравнения этой реакции. Напишите уравнения реакций: а) взаимодействия полученной соли марганца со щелочью; б) окисления полученного гидроксида марганца кислородом воздуха.
445.Составьте уравнения реакций, которые надо провести для осуществления следующих превращений:
Fe ® FeSO4 ® Fe(OH)2 ® Fe(OH)3 ® FeCl3.
Уравнения окислительно-восстановительных реакций напишите на основании электронных уравнений.
446.Какую степень окисления проявляет железо в соединениях? Покажите химические свойства железа, составив электронные и молекулярные уравнения соответствующих реакций взаимодействия: а) с водой при обильном доступе кислорода; б) с водой при недостатке кислорода; в) с разбавленной серной кислотой; г) с разбавленной азотной кислотой.
447.Чем отличается взаимодействие гидроксида кобальта (III) c кислотами от взаимодействия гидроксида железа (III) с кислотами? Почему? Составьте электронные и молекулярные уравнения соответствующих реакций.
448.Составьте уравнения реакций, которые необходимо провести для осуществления превращений:
Co ® Co(NO3)2 ® Co(OH)2 ® Co(OH)3 ® CoSO4 .
Уравнения окислительно-восстановительных реакций напишите на основании электронных уравнений.
449.Составьте молекулярные и ионно-молекулярные уравнения реакций, которые необходимо провести для осуществления следующих превращений: Fe ® FeCl2 ® Fe(CN)2 ® K4[Fe(CN)6] ® K3[Fe(CN)6].
Уравнения окислительно-восстановительных реакций напишите на основании электронных уравнений.
450. Составьте электронные и молекулярные уравнения реакций: а) взаимодействия сульфата железа (II) с подкисленным раствором перманганата калия; б) окисления гидроксида железа (II) в гидроксид железа (III); в) окисления Fe2O3 до феррата натрия в присутствии гидроксида натрия.
 2015-01-30
2015-01-30 4622
4622








