Внутренняя энергия системы Uвн складывается из энергии поступательного и вращательного движения молекул, энергии внутримолекулярного колебательного движений атомов и атомных групп, энергии, заключающейся в ядрах атомов, энергии межмолекулярного взаимодействия.
Uвн является полным дифференциалом, она не зависит от пути процесса, а зависит от начального и конечного состояний системы, она однозначно непрерывна и конечна. Абсолютное значение Uвн определить нельзя, можно определить только ее изменения.
Q и А качественно и количественно характеризуют форму передачи энергии, взаимосвязь между Q, A, Uвн устанавливает первый закон термодинамики.
Внутренняя энергия зависит от состояния вещества. Изменение внутренней энергии системы Δ U при том или ином процессе можно определять. Пусть в результате какого-нибудь процесса система переходит из начального состояния 1 в конечное состояние 2, совершая при этом работу А и поглощая из внешней среды теплоту Q. В термохимических уравнениях положительной принято считать теплоту, выделенную системой. В уравнениях термодинамики принято обратное условие: положительной считается теплота, поглощенная системой.
Внутренняя энергия системы уменьшится на величину А, возрастет на величину Q и в конечном состоянии будет равна U2=Ul + Q – А (1) где U1 и U2— внутренняя энергия системы в начальном (1) и в конечном (2) состояниях. Если обозначить разность U2 — U1через Δ U, то уравнение можно представить в виде:
Δ U = Q – A (2)
Это уравнение выражает закон сохранения энергии, согласно которому изменение внутренней энергии не зависит от способа проведения процесса, а определяется только начальным и конечным состояниями системы. Однако какая часть энергии пойдет на совершение работы, а какая превратится в теплоту — зависит от способа проведения процесса: соотношение между работой и теплотой может быть различным.
В частности, если в ходе процесса не производится никакой работы, в том числе работы расширения против внешнего давления, т. е., если объем системы не изменяется, то Δ U = Qv (3) где Qv — теплота, поглощенная системой в условиях постоянного объема. Последнее уравнение дает возможность определять изменение внутренней энергии при различных процессах. Например, в случае нагревания вещества при постоянном объеме изменение внутренней энергии определяется по теплоемкости этого вещества: Δ U = Qv = nCv ΔT (4) Здесь Cv — молярная теплоемкость вещества при постоянном объеме; п — количество вещества; ΔT —разность между конечной и начальной температурами.
В случае химической реакции, протекающей без изменения объема системы, изменение внутренней энергии равно взятому с обратным знаком тепловому эффекту этой реакции.
Однако чаще в химии приходится иметь дело с процессами, протекающими при постоянном давлении. При этом удобно пользоваться величиной энтальпии Н, определяемой соотношением: Н = U + PV (5)
При постоянном давлении и при условии, что в ходе процесса совершается только работа расширения (А = PΔV). Работа (А)против силы внешнего давления равна величине этой силы (F), умноженной на путь (Δ l), т. е. А = F Δl. Но сила равна давлению (P), (умноженному на ту площадь (S), на которую оно действует: F = PS, откуда А = PS Δ l или А = PΔV)
ΔН = ΔU + P ΔV(6) или ΔU = ΔН — Р ΔV (7)
Сравнивая последнее уравнение с уравнением внутренней энергии Δ U = Q – A (8)
видим, что при указанных условиях ΔН = Qр, где где Qр— теплота, поглощенная системой при постоянном давлении.
Последнее уравнение дает возможность определять изменение энтальпии при различных процессах. Такие определения аналогичны определениям внутренней энергии, с той разницей, что все измерения должны проводиться в условиях постоянного давления. Так, при нагревании вещества изменение его энтальпии определяется по теплоемкости этого вещества при постоянном давлении ΔН = QP = пСр ΔT где п — количество вещества; Ср — молярная теплоемкость вещества при постоянном давлении.
Энтропия (S) – термодинамическая функция состояния, которая служит мерой беспорядка (неупорядоченности) системы. Возможность протекания эндотермических процессов обусловлена изменением энтропии, ибо в изолированных системах энтропия самопроизвольно протекающего процесса увеличивается Δ S > 0 (второй закон термодинамики). Л. Больцман определил энтропию как термодинамическую вероятность состояния (беспорядок) системы W. Поскольку число частиц в системе велико (число Авогадро N A = 6,02∙10 23), то энтропия пропорциональна натуральному логарифму термодинамической вероятности состояния системы W:
|
Размерность энтропии 1 моля вещества совпадает с размерностью газовой постоянной R и равна Дж∙моль –1∙K –1. Изменение энтропии *) в необратимых и обратимых процессах передается соотношениями Δ S > Q / T и Δ S = Q / T. Например, изменение энтропии плавления равно теплоте (энтальпии) плавления Δ S пл = Δ H пл/ T пл Для химической реакции изменение энтропии аналогично изменению энтальпии
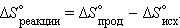 |
*) термин энтропия был введен Клаузиусом (1865 г.) через отношение Q/T (приведенное тепло).
Здесь Δ S ° соответствует энтропии стандартного состояния. Стандартные энтропии простых веществ не равны нулю. В отличие от других термодинамических функций энтропия идеально кристаллического тела при абсолютном нуле равна нулю (постулат Планка), поскольку W = 1.
Энтропия вещества или системы тел при определенной температуре является абсолютной величиной.
Энергией Гиббса (или потенциалом Гиббса, или просто термодинамическим потенциалом в узком смысле) называюттермодинамический потенциал следующего вида: 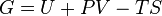 ,где U — внутренняя энергия, P — давление, V — объем, T — абсолютнаятемпература, S — энтропия. Энергию Гиббса можно понимать как полную химическую энергию системы (кристалла, жидкости и т.д.)
,где U — внутренняя энергия, P — давление, V — объем, T — абсолютнаятемпература, S — энтропия. Энергию Гиббса можно понимать как полную химическую энергию системы (кристалла, жидкости и т.д.)
Дифференциал энергии Гиббса для системы с постоянным числом частиц: 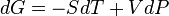 .
.
Для системы с переменным числом частиц этот дифференциал записывается так: 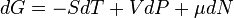
Здесь 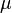 — химический потенциал, который можно определить как энергию, которую необходимо затратить, чтобы добавить в систему ещё одну частицу.
— химический потенциал, который можно определить как энергию, которую необходимо затратить, чтобы добавить в систему ещё одну частицу.
химический потенциал есть отношение энергии Гиббса к числу частиц в системе: 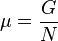
 2015-01-30
2015-01-30 3091
3091
