Энергия Гиббса - это часть энергососдержания системы, которое можно использовать для совершения полезной работы. При изотермических условиях (Т – const) изменение энергии Гиббса определяет направленность химических процессов. Расчет DG реакции позволяет установить термодинамическую возможность протекания реакции.
Если для химической реакции DG < 0, то говорят, что такая реакция термодинамически возможна. Если DG < 0, то реакция не будет протекать ни при каких условиях. Если DG = 0, то система находится в состоянии химического равновесия.
Возможно несколько вариантов изменения сумм энтальпий образования и энтропий веществ в ходе процесса.
1.  Н < 0,
Н < 0,  S > 0. Процесс однозначно энергетически выгоден и может протекать самопроизвольно.
S > 0. Процесс однозначно энергетически выгоден и может протекать самопроизвольно.
2.  Н > 0,
Н > 0,  S < 0. Процесс однозначно энергетически невыгоден и не может протекать самопроизвольно.
S < 0. Процесс однозначно энергетически невыгоден и не может протекать самопроизвольно.
3.  Н < 0,
Н < 0,  S < 0. Уменьшение
S < 0. Уменьшение  Н благоприятно для самопроизвольного протекания реакции, тогда как уменьшение
Н благоприятно для самопроизвольного протекания реакции, тогда как уменьшение  S препятствует этому. (Неясно, возможно ли самопроизвольное протекание такой реакции.)
S препятствует этому. (Неясно, возможно ли самопроизвольное протекание такой реакции.)
4.  Н > 0,
Н > 0,  S > 0. Увеличение
S > 0. Увеличение  Н не способствует самопроизвольному протеканию реакции, однако возрастание
Н не способствует самопроизвольному протеканию реакции, однако возрастание  S повышает ее вероятность. (Неясна возможность самопроизвольного протекания такой реакции.)
S повышает ее вероятность. (Неясна возможность самопроизвольного протекания такой реакции.)
Роль арбитра, определяющего возможность самопроизвольного протекания реакции при постоянном давлении, играет энергия Гиббса:
 G =
G =  Н – T
Н – T  S, где T – абсолютная температура, К.
S, где T – абсолютная температура, К.
При  G < 0 реакция может протекать самопроизвольно, а при
G < 0 реакция может протекать самопроизвольно, а при  G > 0 реакция термодинамически запрещена. Если
G > 0 реакция термодинамически запрещена. Если  G = 0, то реакционная система находится в состоянии равновесия (скорости прямой и обратной реакций равны).
G = 0, то реакционная система находится в состоянии равновесия (скорости прямой и обратной реакций равны).
Самопроизвольное протекание эндотермической реакции возможно лишь тогда, когда она сопровождается значительным увеличением энтропии. Примером такого процесса является взаимодействие гексагидрата дихлорида кобальта с хлористым тионилом, сопровождающееся ярко выраженным эндотермическим эффектом ( Н = +400 кДж/моль, наблюдается обледенение). Уравнение реакции
Н = +400 кДж/моль, наблюдается обледенение). Уравнение реакции
СоСl2•6Н2О + 6SOCl2 = CoCl2 + 6SO2 + 12HCl
вскрывает причину протекания такого сильно эндотермического процесса: на 1 моль прореагировавшего кристаллогидрата образуется 18 моль (!) газообразных веществ.
Возможность или невозможность протекания реакции устанавливают с помощью уравнения Гиббса следующими способами.
1. Для температуры 25 °С на основе табличных данных рассчитывают  G 0 по соотношению:
G 0 по соотношению:
 G 0 =
G 0 =  Н 0– 298
Н 0– 298  S 0.
S 0.
2. Для температуры, отличающейся от 25 °С, расчет проводят по соотношению:
 G =
G =  G 0 + RT ln K р.
G 0 + RT ln K р.
K р при данной температуре можно найти, преобразовав выражение для равновесия
 G = 0
G = 0 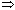
 G 0 + RT ln K р = 0
G 0 + RT ln K р = 0
к виду: 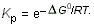
Это соотношение позволяет получить значение константы равновесия при любой температуре.
3. Для окислительно-восстановительных реакций выражение для энергии Гиббса при стандартных условиях принимает следующий вид:  G 0 = – nF
G 0 = – nF 
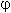 0, где n – количество передаваемых электронов, F – постоянная Фарадея (
0, где n – количество передаваемых электронов, F – постоянная Фарадея ( 96 500 Кл/моль),
96 500 Кл/моль),

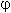 0 – ЭДС реакции. Из этого выражения следует, что реакция протекает при положительном значении ЭДС.
0 – ЭДС реакции. Из этого выражения следует, что реакция протекает при положительном значении ЭДС.
4. Из условия равновесия реакции ( G = 0) имеем: 0 =
G = 0) имеем: 0 =  Н – T
Н – T  S. Отсюда Т =
S. Отсюда Т =  Н /
Н /  S – температура, при которой реакция находится в состоянии равновесия.
S – температура, при которой реакция находится в состоянии равновесия.
Теплоты образования сложных веществ в подавляющем большинстве случаев измерены (или вычислены) в отношении образования их из молекул простых веществ. Их обычно относят к 1 молю сложного вещества.
Теплотой образования сложного вещества называется количество энергии, выделенное или поглощенное при образовании одной грамм-молекулы сложного вещества из простых веществ.
Теплотой образования сложного вещества называется количество энергии, выделяемое или поглощаемое при образовании одного моля сложного вещества из простых веществ.
 2015-01-30
2015-01-30 3269
3269
