К таким реакциям относят реакции, скорость которых пропорциональна концентрации каждого из реагирующих веществ или квадрату концентрации одного из них.
Реакции третьего порядка встречаются достаточно редко, поэтому мы не будем их рассматривать подробно.
Отметим только, что для реакции третьего порядка
A + B + C → продукты
кинетическое уравнение имеет вид
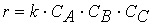
Некоторые реакции, осложнённые адсорбционными стадиями, имеют дробный порядок 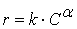 ,где α < 1.
,где α < 1.
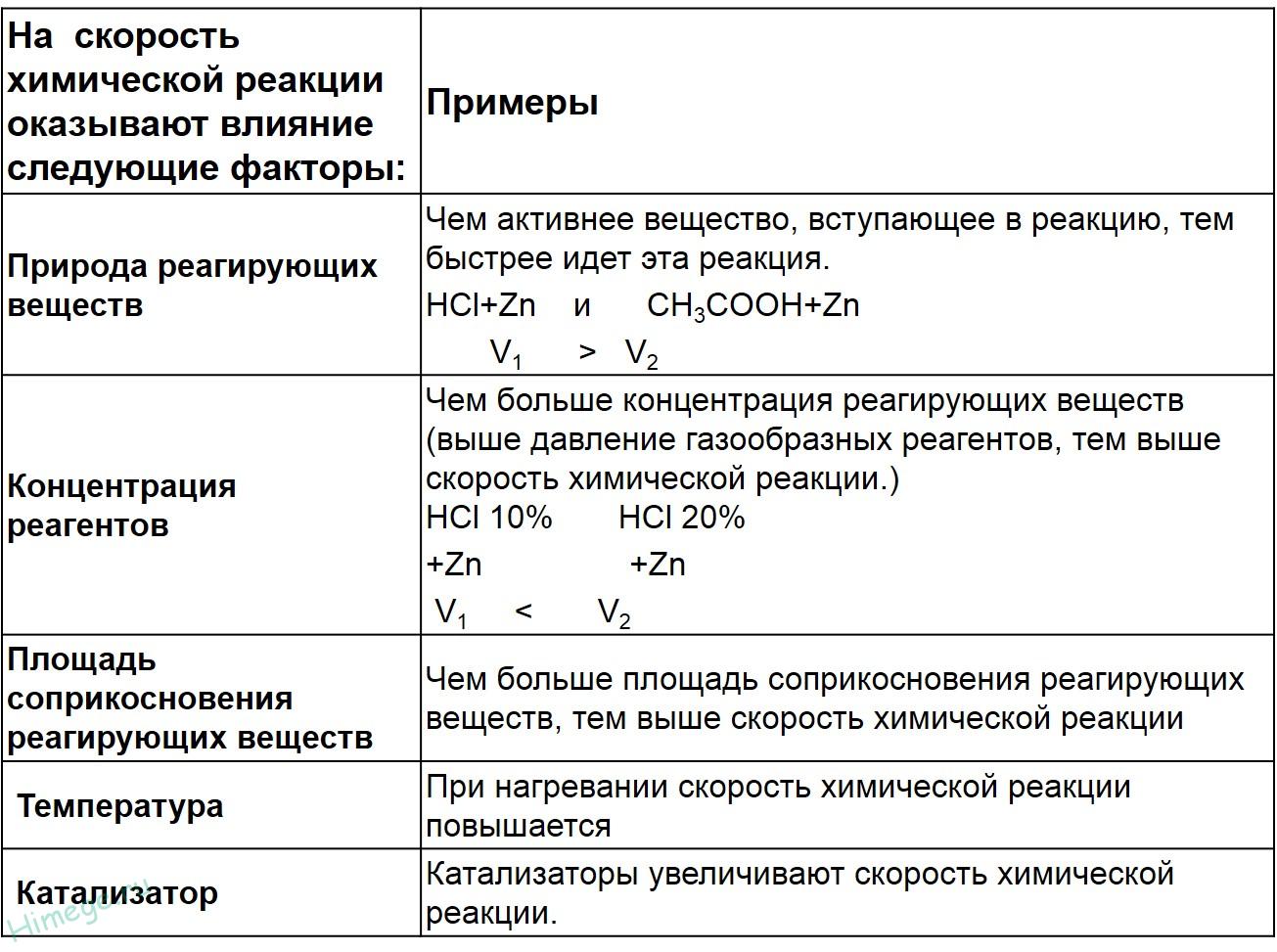
Зависимость скорости реакции от концентрации реагирующих веществ определяется законом действующих масс: Скорость химической реакции, протекающей при постоянной температуре в гомогенной системе, пропорциональна произведению концентрации реагирующих веществ, возведенных в степень их стехиометрических коэффициентов.
Для гомогенной реакции, записанной в общем виде, m A (г) + n B (г) = C (г). Скорость реакции может быть выражена уравнением
v = k[A] m  [ В]n
[ В]n
Правило Вант-Гоффа:
При повышении температуры на каждые 10 градусов скорость реакции возрастает примерно в 2-4 раза.
v2 = v1*yΔt/10.
v - скорость реакции.
y (гамма) - температурный коэффициент скорости - число, характеризующее ускорение реакции при нагревании на 10 градусов.
Δt - разность температур.
Закон действия масс (ЗДМ):
Скорость химической реакции пропорциональна произведению концентраций реагирующих веществ.
Например, для реакции aА + bВ = С, v = k*[A]a * [В]b,
k - константа скорости, [A]и [В] - концентрации реагирующих веществ, a и b - стехиометрические коэффициенты.
 2015-01-30
2015-01-30 1925
1925
