Скорость химической реакции прямо пропорциональна произведению концентраций реагирующих веществ.aA + bB +....
V = k • [A]a • [B]b •...
Константа скорости реакции k зависит от природы реагирующих веществ, температуры и катализатора, но не зависит от значения концентраций реагентов.
Физический смысл константы скорости заключается в том, что она равна скорости реакции при единичных концентрациях реагирующих веществ.
Для гетерогенных реакций концентрация твердой фазы в выражение скорости реакции не входит.
Гомогенными называются химические реакции, у которых исходные вещества находятся в одинаковом агрегатном состоянии или в одной и той же (жидкой либо газообразной) фазе. При этом между веществами отсутствует поверхность раздела.
Например:1) 2Н2 (газ) + О2 (газ) = 2 Н2О(ж.) гомогенная реакция, протекающая в газовой фазе;
2) KCl (p.-p.) + AgNO3 (p.-p.) = AgСl↓ (тв.)↓ + KNO3 (p.-p. гомогенная реакция, протекающая в жидкой фазе.
Характерной особенностью гомогенных реакций является то, что они осуществляются во всём объёме системы, т.е. столкновение молекул либо ионов исходных веществ может произойти в любой её точке.
Гетерогенными называются химические реакции, в которых исходные вещества находятся в разных фазах и, как правило, отличаются друг от друга агрегатным состоянием. Но могут быть гетерогенные реакции, в которых различные фазы находятся в одном и том же агрегатном состоянии. Например, две несмешивающиеся между собой жидкости: углеводород и вода. В таких системах между исходными веществами всегда присутствует поверхность раздела, на которой и протекает гетерогенная реакция.
Например:1) С(тв.) + О2 (г.) = СО2
2) 2Н2О (ж.) + Са (тв.) = Са(ОН)2 (р.-р.) + Н2 (г.)
Гетерогенные реакции, протекающие на поверхности твёрдого вещества;
3) Н2О (ж.) + 2NO2 (г.) = HNO3 (p.-p.) + HNO2 (p.-p.)
Гетерогенная реакция, протекающая на поверхности жидкости.
При рассмотрении биохимических процессов, протекающих в живом организме, часто бывает трудно отнести их к соответствующему типу, т.к. в некоторых случаях невозможно однозначно определить агрегатное состояние всех исходных веществ. Особенно это касается реакций, протекающих внутри или на поверхности биологических мембран, а также с участием биополимеров (белков, полисахаридов). В то же время, принадлежность реакции к гомогенному или гетерогенному типу оказывает значительное влияние не только на величину скорости, но и на способ её определения.
При этом под скоростью (υ) гомогенной реакции подразумевают изменение числа молей одного из веществ (конечного или начального) за единицу времени в единице объема системы:
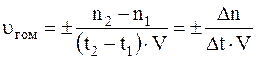 ,
,
Число молекул, вступающих в реакцию, определяют молекулярность реакции.
Так, если в реакцию вступает одна молекула, то такая реакция называется молекулярной реакцией. Если в реакции участвуют две молекулы (безразлично, одинаковые или нет), то такая реакция называется бимолекулярной. Встречаются также тримолекулярные реакции.
Реакции более высокой степени молекулярности крайне редки из–за малой вероятности одновременного столкновения большого числа молекул.
Поэтому большинство реакций протекают в несколько элементарных, простых стадий, в которых участвует небольшое число молекул.
Так, например, рассмотренная выше реакция 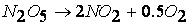
протекает по следующему механизму:
первая стадия
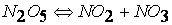
вторая стадия (медленная)
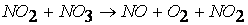
третья стадия
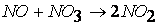
Определить такие стадии – значит определить механизм, или путь реакции.
Скорость всей реакции определяется скоростью её наиболее медленной стадии, которая и определяет механизм.
Поэтому закон действующих масс справедлив только для таких элементарных стадий.
Молекулярность реакции легко определить в случае простых реакций, протекающих в одну стадию. В большинстве же случаев довольно трудно найти молекулярность реакции.
Поэтому вводится понятие порядка реакции, который можно найти из кинетических уравнений, полученных экспериментально.
Порядок реакции по данному веществу равен степени, в которой концентрация данного вещества входит в уравнение скорости реакции.
Сумма показателей степеней, в которых концентрация всех исходных веществ входит уравнение скорости реакции, равна порядку реакции в целом. Порядок химической реакции по веществу совпадает со стехиометрическим коэффициентом реакции лишь в очень простых реакциях, например в реакции синтеза йодистого водорода:
H2 + I2 ® 2HI.
Порядок этой реакции по водороду (первый) и йоду (первый) равны стехиометрическими коэффициентами, а общий порядок реакции (второй) равен сумме стехиометрических коэффициентов в уравнении скорости реакции
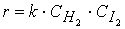
В подавляющем большинстве случаев порядок реакции по веществу отличается от стехиометрических коэффициентов уравнения реакции для этого вещества.
Соответственно общий порядок реакции обычно не равен сумме стехиометрических коэффициентов уравнения реакции.
Например, реакция
NO2 + CO ® CO2 + NO,
при температурах, меньших 298К, протекает по следующему механизму:
первая стадия процесса: NO2 + NO2 ® NO3 + NO
вторая стадия процесса: NO3 + CO ® CO2 + NO2,
причем лимитирующей, т.е. скорость определяющей стадией является первая стадия процесса:
NO2 + NO2 ® NO3 + NO
Тогда, согласно первому постулату химической кинетики, который утверждает, что скорость всей реакции равна скорости его самой медленной стадии, можно записать:
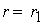 ,
,
где 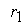 - скорость первой стадии процесса.
- скорость первой стадии процесса.
Согласно второму постулату химической кинетики, который утверждает, что скорость элементарной (одностадийной) реакции пропорциональна концентрации реагирующих веществ в степенях, равных стехиометрическим коэффициентам, получим зависимость скорости реакции
NO2 + CO ® CO2 + NO
от концентрации реагирующих веществ:
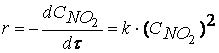
Обратите внимание, что скорость реакции
NO2 + CO ® CO2 + NO
не зависит от концентрации оксида углерода CO.
Уравнение, выражающее зависимость скорости реакции от концентрации каждого вещества, называют кинетическим уравнением реакции в дифференциальной форме.
К сожалению, кинетическое уравнение реакции может быть получено только при её экспериментальном изучении и не может быть выведено из стехиометрического уравнения.
 2015-01-30
2015-01-30 2660
2660








