Энергия связи – это энергия, которая выделяется при образовании молекулы из одиночных атомов. Энергия связи - это энергия, которая поглощается при удалении двух атомов на бесконечно большое расстояние друг от друга. А энтальпия образования - это теплота, которая выделяется при получении вещества из простых веществ, то есть, если говорить на языке энергий связи, сначала атомы простых веществ разносятся на бесконечно большое расстояние (с поглощением энергии), потом соединяются с образованием нужного вещества (выделяется энергия). Разность - энтальпия образования.
Энергия связи отличается от ΔHобр. Теплота образования – это энергия, которая выделяется или поглощается при образовании молекул из простых веществ. Так:
N2 + O2 → 2NO + 677,8 кДж/моль – ∆Hобр.
N + O → NO - 89,96 кДж/моль – Е св.
Для двухатомных молекул энергия связей равна энергии диссоциации, взятой с обратным знаком: например в молекуле F2 энергия связи между атомами F-F равна - 150,6 кДж/моль.
Для многоатомных молекул с одним типом связи, например, для молекул АВn, средняя энергия связи равна 1/n части полной энергии образования соединения из атомов. Так, энергия образования СН4 = -1661,1 кДж/моль. Так как в молекуле СН4 четыре связи, то энергия одной связи С – Н равна 415,3 кДж/моль. Исследование большого числа известных в настоящее время данных по энергиям связи показывает, что энергия связи между конкретной парой атомов часто оказывается величиной постоянной при условии, что остальная часть молекулы изменяется незначительно. Так, в насыщенных углеводородах Есв (C – Н) = 415,3 кДж/моль, Есв (C – С) = 331,8 кДж/моль.
Энергии связей в молекулах, состоящих из одинаковых атомов, уменьшаются по группам сверху вниз По периоду энергии связей растут. В этом же направлении возрастает и сродство к электрону
В прошлом параграфе мы привели пример вычисления теплового эффекта реакции:
С(тв) + 2 H2(г) = CH4(г) + 76 кДж/моль.
В данном случае 76 кДж - это не просто тепловой эффект данной химической реакции, но еще и теплота образования метана из элементов.
ЭНТАЛЬПИЯ - это тепловой эффект реакции, измеренный (или вычисленный) для случая, когда реакция происходит в открытом сосуде (т.е. при неизменном давлении). Обозначается как ΔH.
Когда объем, занимаемый продуктами реакции, отличается от объема, занимаемого реагентами, химическая система может совершить дополнительную работу PΔV (где P - давление, а ΔV - изменение объема). Поэтому ΔН и ΔЕ связаны между собой соотношением:
ΔН = ΔЕ + PΔV
Итак, если реакция проводится не в "бомбе", то ЭНТАЛЬПИЯ и ТЕПЛОВОЙ ЭФФЕКТ совпадают между собой. Энтальпию называют также "теплосодержанием". Если мы проводим реакцию получения воды в открытом сосуде, то 286 кДж/моль - это "тепло" ΔН, содержащееся в водороде и кислороде для случая, когда мы получаем из них воду. Поскольку исходные вещества (водород и кислород) находились в нашем опыте в стандартных условиях (25 оС и давлении 1 атм), а продукт реакции (воду) мы тоже привели к стандартным условиям, мы вправе сказать, что 286 кДж/моль - это СТАНДАРТНАЯ ТЕПЛОТА ОБРАЗОВАНИЯ ВОДЫ или, что то же - СТАНДАРТНАЯ ЭНТАЛЬПИЯ ОБРАЗОВАНИЯ ВОДЫ. Если мы будем получать из тех же элементов не воду, а перекись водорода H2O2, то "теплосодержание" такой химической системы будет иным (187,6 кДж/моль). Во время протекания реакций с образованием 1 моля воды или 1 моля H2O2 освобождается разное количество энергии, чего и следовало ожидать. В дальнейшем стандартную теплоту образования веществ мы чаще будем называть именно стандартной энтальпией образования ΔН. Чтобы подчеркнуть справедливость этой величины только для стандартных условий, в таблицах её обозначают следующим образом: ΔНо298
Маленький "нолик" рядом с ΔН по традиции символизирует некое стандартное состояние, а цифра 298 напоминает, что значения приведены для веществ при 25 оС (или 298 К). Стандартная энтальпия не обязательно должна быть энтальпией образования вещества из элементов. Можно получить значение стандартной энтальпии ΔНо298 для любой химической реакции. Но в нашем случае с получением воды из водорода и кислорода мы получили именно стандартную энтальпию образования воды. Записывается это так: H2 + 0,5 O2 = H2O (ΔНо298 = -286 кДж/моль)
Откуда взялся знак "минус" перед значением теплового эффекта? Здесь автор со вздохом должен сообщить читателю о еще одной особенности представления теплоты (и энтальпии) в термодинамике. Здесь принято потерянную любой системой энергию представлять со знаком "минус". Рассмотрим, например, уже знакомую нам систему из молекул метана и кислорода. В результате экзотермической реакции между ними происходит выделение теплоты: СH4(г) + 2 O2(г) = СO2(г) + 2 H2О(ж) + 890 кДж
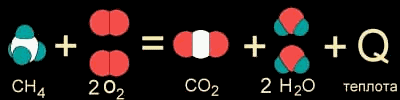
Можно записать эту реакцию и другим уравнением, где выделившаяся ("потерянная") теплота имеет знак "минус": СH4(г) + 2 O2(г) – 890 кДж = СO2(г) + 2 H2О(ж)
По традиции энтальпию этой и других экзотермических реакций в термодинамике принято записывать со знаком "минус": ΔНо298 = –890 кДж/моль (энергия выделяется).
Наоборот, если в результате эндотермической реакции система поглотила энергию, то энтальпия такой эндотермической реакции записывается со знаком "плюс". Например, для уже знакомой нам реакции получения CO и водорода из угля и воды (при нагревании): C(тв) + H2О(г) + 131,3 кДж = CO(г) + H2(г)
(ΔНо298 = +131,3 кДж/моль)
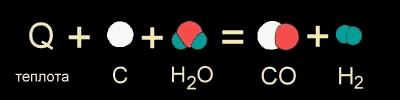
К этой особенности термодинамического языка следует просто привыкнуть, хотя на первых порах путаница со знаками может изрядно досаждать при решении задач.
Давайте попробуем решить одну и ту же задачу сначала в термодинамической шкале (где выделяемая реакцией теплота имеет знак "минус"), а потом в термохимической шкале (которой мы пользовались в предыдущем параграфе и где выделяемая реакцией энергия имеет знак "плюс").
Итак, приведем пример расчета теплового эффекта реакции: Fe2O3(тв) + 3 C(графит) = 2 Fe(тв) + 3 CO(г)
Эта реакция происходит в доменной печи при очень высокой температуре (около 1500 оС). В справочниках, где используется термодинамическая шкала, можно найти стандартные теплоты образования Fe2O3 (ΔНо298 = –822,1 кДж/моль) и СО (ΔНо298 = – 110,5 кДж/моль). Два других вещества из этого уравнения - углерод и железо - являются элементами, то есть их теплота образования по определению равна нулю. Поэтому стандартная теплота рассматриваемой реакции равна:
ΔНо298 = 3× (-110,5) - (-822,1) = -331,5 + 822,1 = +490,6 кДж
Итак, реакция восстановления оксида железа (III) углерода является эндотермической (ΔНо298 положительна!), причем на восстановление одного моля Fe2O3 тремя молями углерода надо было бы затратить 490,6 кДж, если исходные вещества до начала реакции и продукты после окончания реакции находятся в стандартных условиях (то есть при комнатной температуре и атмосферном давлении). Не имеет значения, что исходные вещества пришлось сильно нагреть для того, чтобы реакция произошла. ВеличинаΔНо298 = +490,6 кДж отражает "чистый" тепловой эффект эндотермической реакции, в которой реагенты сначала разогревались внешним источником тепла от 25 до 1500 оС, а в конце реакции продукты опять остывали до комнатной температуры, отдав все тепло в окружающую среду. При этом отданного тепла будет меньше, чем пришлось потратить на разогрев, потому что часть тепла поглотилась в реакции.
Проведем тот же расчет, используя термохимическую шкалу. Допустим, известны теплоты сгорания углерода и железа в кислороде (при неизменном давлении):
1) C + 1/2 O2 = CO + 110,5 кДж
2) 2 Fe + 3/2 O2 = Fe2O3 + 822,1 кДж
Чтобы получить тепловой эффект интересующей нас реакции, умножим первое уравнение на 3, а второе перепишем в обратном порядке:
1) 3 C + 3/2 O2 = 3 CO + 331,5 кДж
2) Fe2O3 + 822,1 кДж = 2 Fe + 3/2 O2
Теперь почленно сложим оба уравнения:3 C + 3/2 O2 + Fe2O3 + 822,1 кДж = 3 CO + 331,5 кДж + 2 Fe + 3/2 O2
После сокращения в обоих частях уравнения кислорода (3/2 O2) и переноса 822,1 кДж в правую часть получим: 3 C + Fe2O3 = 3 CO + 2 Fe – 490,6 кДж
кинетика химических реакций — раздел физической химии, изучающий закономерности протекания химических реакций во времени, зависимости этих закономерностей от внешних условий, а также механизмы химических превращений Химическая кинетика – наука о скоростях и закономерно-стях протекания химических процессов во времени.
Химическая кинетика изучает механизм протекания процесса, т.е. те промежуточные стадии, состоящие из элементарных актов, через которые система переходит из начального состояния в конечное.
Химическая кинетика изучает скорости этих стадий и факторы, влияющие на их скорость.
Уравнение химической реакции показывает начальное состояние системы (исходные вещества) и её конечное состояние (продукты реакции), но не отражает механизма процесса.
 2015-01-30
2015-01-30 13011
13011
