1. Найдём центральный атом (ц.а.) в молекуле – тот атом, степень окисления которого выше независимо от знака.
1. Н2+О-2 => ц.а. – О (ст.ок.) = -2 => в атоме 2 неспаренных ē.
2. Определим число периферийных атомов (Н) – координационное число (к.ч.), которое указывает на число σ-связей.
 |

 2. К.ч.(О) = 2 => 2 σ-связи. σ О σ Н
2. К.ч.(О) = 2 => 2 σ-связи. σ О σ Н
 Н
Н
3. Составим графическое изображение валентных электронов ц.а. в соответствующей степени окисления.
 |
8О 1s2 2s22p4
IIп. IVA вал. 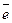
2p
| ↑↓ | ↑ | ↑ | |
| ↑↓ | |||
2s
 |
4. Определим тип гибридизации, зная, что в гибридизации участвуют только те валентные А.О., которые образуют σ-связи (орбитали с неспаренными электронами, а также орбитали со спаренными электронами последнего энергетического уровня (Э.У.). На графическом изображении отсечём А.О., идущие на образование 2-х σ -связей и орбитали со спаренными электронами
 |
  
| ↑ | ↑ |
2p
2s => тип гибридизации sp3
2 σ -связи
 | |||
 |
5. Изобразим гибридизацию рисунком (см. табл. п.3).
 |
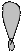






 р ↑↓
р ↑↓

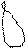

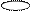
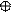 + p → → O
+ p → → O


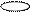
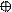
 p
p

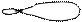 s ↑ ↓
s ↑ ↓
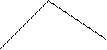 | |||||
 | |||||
 |
 6. Покажем перекрывание А.О. ц.а. – О – с переферийными атомами – Н (зная, что от него в образовании связей участвуют 1s1орбитали.
6. Покажем перекрывание А.О. ц.а. – О – с переферийными атомами – Н (зная, что от него в образовании связей участвуют 1s1орбитали.
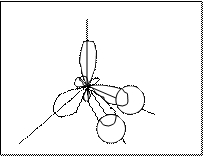 |
↑↓
↑↓ H
H
7. Изобразим геометрию частицы (см. табл.1 п.3).
 |
↑↓
↑↓ 

 O
O
H H
Угловая молекула
 |
 2015-01-07
2015-01-07 2719
2719








