(модельная, теоретическая) – нет (реальная) – есть теплообмен с
теплообмена с окружающей средой окружающей средой энергией и







 веществом
веществом
 |










 изоляция
изоляция
 |  |
 Энтропия - D S = DQ Чем тело больше нагрето, тем вероятнее,
Энтропия - D S = DQ Чем тело больше нагрето, тем вероятнее,
 T что оно будет охлаждаться сильнее.
T что оно будет охлаждаться сильнее.
    Изменение энтропии в изолированной системе. Изменение энтропии в изолированной системе.
DSA = - ΔQ А - ΔTA тепло, которое тело А отдаёт телу В. DSв = + Δ QВ - TВ тепло, которое тело В получает.
DS системы = DSА + DSВ = - ΔQA + ΔQB TA TB
TВ TA
Второй закон термодинамики В изолированных системах самопроизвольно протекают только такие процессы, в которых энтропия возрастает. DS > 0 Энтропия - DS – мера беспорядка в системе (справочная величина) DSо обр. – Дж/моль *К |  Изменение свободной энергии Гиббса (изобарно-
изотермического потенциала) для реальных (открытых) систем
DGх.р. – критерий самопроизвольного протекания химической реакции.
DGх.р. – свободная энергия.
DНх.р. – полная энергия (энтальпийный фактор)
Т *DS – связанная энергия (энтропийный фактор)
1. Химическая реакция возможна, если DGх.р. < 0
2.Химическая реакция невозможна, если DGх.р. > 0
3. В системе наступило динамическое химическое равновесие,
если DGх.р. = 0 Изменение свободной энергии Гиббса (изобарно-
изотермического потенциала) для реальных (открытых) систем
DGх.р. – критерий самопроизвольного протекания химической реакции.
DGх.р. – свободная энергия.
DНх.р. – полная энергия (энтальпийный фактор)
Т *DS – связанная энергия (энтропийный фактор)
1. Химическая реакция возможна, если DGх.р. < 0
2.Химическая реакция невозможна, если DGх.р. > 0
3. В системе наступило динамическое химическое равновесие,
если DGх.р. = 0
|
|
Свободную энергию Гиббса можно рассчитать 2 способами:
 Расчет DGх.р.
Расчет DGх.р.
 2015-01-07
2015-01-07 499
499




 -ΔQA = ΔQB, так как теплообмен возможен только между телами
-ΔQA = ΔQB, так как теплообмен возможен только между телами
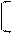 DS системы = ΔQB 1 – 1 >0
DS системы = ΔQB 1 – 1 >0






