Принцип Ле Шателье: если изменить одно из условий (С,р,Т), при которых система находилась в состоянии равновесия, то, равновесие смещается в сторону той реакции, которая противодействует произведённому изменению.
3 H2 + N2 «2 NH3 3 H2 + N2 «2 NH3
[H2] [H2]¯
 |  |
[N2] [N2] ¯
 | |||
 | |||
[NH3] [NH3] ¯
 | |||
 | |||
2. Влияние давления:
 3 H2 + N2 «2 NH3
3 H2 + N2 «2 NH3
3 +1 = 4 моль 2 моль
р р¯
р
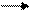
р¯
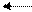
3 H2 + N2 «2 NH3 (- D Н х.р.) Þ экзотермическая реакция
t°¯ t°
 t°
t°
t°¯
C исходная = С равновесная + С израсходованная к моменту равновесия
С равновесная = С исходная – С израсходованная к моменту равновесия
РЕШЕНИЕ ТИПОВОЙ ЗАДАЧИ ПО ТЕМЕ:
Задача
Равновесие гомогенной системы: 2 NO + O2 «2 NO2, - установилось при следующих концентрациях веществ:
[NO]p. = 0,8 моль/л., [O2]p.= 0,6 моль/л, [NO2]p. = 0,4 моль/л Вычислите исходные концентрации NO и O2.
 Дано: 2 NO + O2 «2 NO2
Дано: 2 NO + O2 «2 NO2
[NO]p. = 0,8 моль/л, Решение:
[O2]p.= 0,6 моль/л, 1. Cисх. = С равн. + С израсх к моменту равновесия
[NO2]p. = 0,4 моль/л 2. Определим сколько моль NO и О2 израсходовано
[NO]исх. =? к моменту равновесия.
[O2]исх =?
Согласно уравнению реакции:
2 моль NO вступает в химическую реакцию и образуется 2 моль NO2
X моль NO - 0,4 моль NO2
[NO] израсх. = 2 *0,4/2 = 0,4 моль
1 моль O2 вступает в химическую реакцию и образуется 2 моль NO2
Х моль О2 – 0,4 моль NO2
[O2] израсх. = 0,4/2 =0,2 моль
3. [NO] исх. = 0,8 +0,4 =1,2 моль/л
[O2] исх. = 0,6 + 0,2 = 0,8 моль/л
Ответ: [NO]исх. = 1,2 моль/л, [O2] исх. = 0,8 моль/л
 2015-01-07
2015-01-07 788
788








