Пример 1. В баллоне вместимостью V =6,9 л находится азот массой m =2,3 г. При нагревании часть молекул диссоциировали на атомы. Коэффициент диссоциации a =0,2. Определить: 1) общее число N 1 молекул и концентрацию n 1 молекул азота до нагревания; 2) концентрацию n 2 молекул и n 3 атомов азота после нагревания.
Решение. По определению, концентрация частиц газа есть отношение числа частиц к вместимости сосуда, занимаемого газом:
n=N /V. (1)
1. Число N 1 молекул газа до нагревания найдем из соотношения
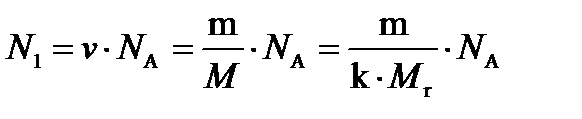 . (2)
. (2)
где v — количество вещества азота; n a — постоянная Авогадро; М — молярная масса азота; M r — относительная молекулярная масса азота; k =10-3 кг/моль. Подставив значения величин в (2), получим
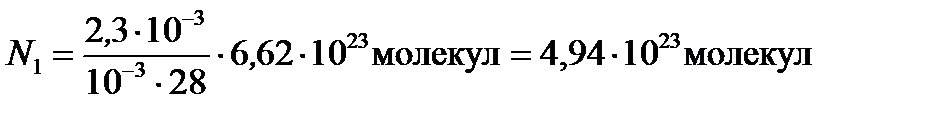 .
.
Концентрацию n 1 найдем, подставив значения величин в (1):
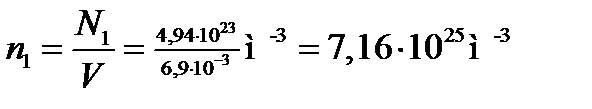 .
.
2. Концентрацию после нагревания найдем из соотношения
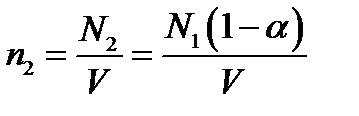 , (3)
, (3)
где N — число молекул, не распавшихся на атомы.
После подстановки значений величин в (3) получим
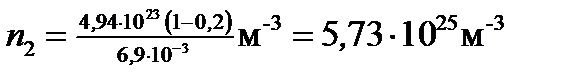 .
.
Концентрация атомов после нагревания азота
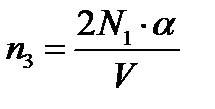 . (4)
. (4)
Число 2 в формуле (4) выражает тот факт, что каждая молекула после распада дает два атома.
Подставим в (4) значения величин и произведем вычисления:
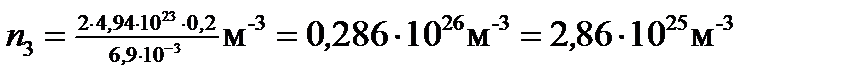 .
.
Пример 2. В колбе вместимостью V =0,5 л находится кислород при нормальных условиях. Определить среднюю энергию 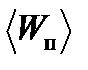 поступательного движения всех молекул, содержащихся в колбе.
поступательного движения всех молекул, содержащихся в колбе.
Решение. Средняя энергия 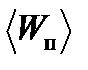 поступательного движения всех молекул может быть выражена соотношением
поступательного движения всех молекул может быть выражена соотношением
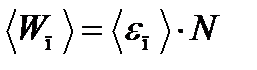 , (1)
, (1)
где < e п>— средняя энергия поступательного движения одной молекулы; N — число всех молекул, содержащихся в колбе.
Как известно,
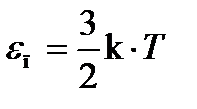 , (2)
, (2)
где k — постоянная Больцмана; Т — термодинамическая температура.
Число молекул, содержащихся в колбе, найдем по формуле
N = v∙N A, (3)
где v — количество вещества кислорода; N A — постоянная Авогадро.
Количество вещества v найдем из таких соображений: известно, что при нормальных условиях молярный объем V m равен 22,4×10-3 м3/моль. Так как, по условию задачи, кислород в колбе находится при нормальных условиях, то количество вещества кислорода в колбе выражается соотношением
v=V/Vm. (4)
Подставив выражение v по (4) в (3), получим
N = V∙N A/ V m. (5)
С учетом (2) и (5) выражение (1) энергии поступательного движения молекул примет вид
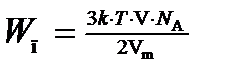 (6)
(6)
Подставив значения величин в (6) и произведя вычисления, найдем
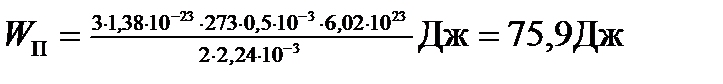 .
.
Пример 3. Средняя длина свободного пробега< l > молекулы углекислого газа при нормальных условиях равна 40 нм. Определить среднюю арифметическую скорость < J > молекул и число z соударений, которые испытывает молекула в 1 с.
Решение. Средняя арифметическая скорость молекул определяется по формуле
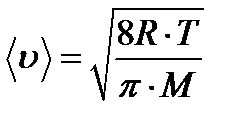 ,
,
где М — молярная масса вещества.
Подставив числовые значения, получим
< υ >=362 м/с.
Среднее число <z> соударений молекулы в 1 с определяется отношением средней скорости < υ > молекулы к средней длине ее свободного пробега< l >:
<z>=<υ>/<l>.
Подставив в эту формулу значения < υ >=362 м/с, < l >=40 нм=4×10-8 м, получим
< z >= 9,05×109 с-1.
Пример 4. Два тонкостенных коаксиальных цилиндра длиной l= 10 см могут свободно вращаться вокруг их общей оси z. Радиус R большого цилиндра равен5 см. Между цилиндрами имеется зазор размером d=2 мм. Оба цилиндра находятся в воздухе при нормальных условиях. Внутренний цилиндр приводят во вращение с постоянной частотой n 1=20 с-1. Внешний цилиндр заторможен. Определить, через какой промежуток времени с момента освобождения внешнего цилиндра он приобретет частоту вращения n 2 = 1c-1. При расчетах изменением относительной скорости цилиндров пренебречь. Масса m внешнего цилиндра равна100 г.
Решение. При вращении внутреннего цилиндра слой воздуха увлекается им и начинает участвовать во вращательном движении. Вблизи поверхности этого цилиндра слой воздуха приобретает со временем практически такую же линейную скорость, как и скорость точек на поверхности цилиндра, т. е. υ =2p∙ n 1∙(R – d). Так как d «R, то приближенно можно считать
υ»2p∙n1∙R (1)
Вследствие внутреннего трения момент импульса передается соседним слоям газа и в конечном счете внешнему цилиндру. За интервал времени Dt внешний цилиндр Приобретает момент импульса L=p∙R, где р — импульс, полученный за D t внешним цилиндром. Отсюда
p = L/R. (2)
С другой стороны,
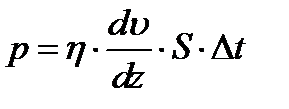 , (3)
, (3)
где h — динамическая вязкость; 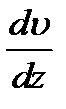 —градиент скорости; S —площадь поверхности цилиндра (S =2p∙ R∙l).
—градиент скорости; S —площадь поверхности цилиндра (S =2p∙ R∙l).
Приравняв правые части выражений (2) и (3) и выразив из полученного равенства искомый интервал Dt, получим
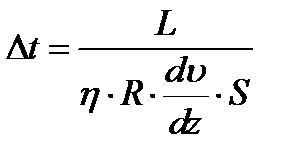 .
.
Найдем входящие в эту формулу величины L, 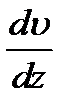 и S. Момент импульса L=J∙w 2, где J — момент инерции цилиндра (J = m∙R 2); m — его масса; w 2 — угловая скорость внешнего цилиндра (w 2=2p∙ n 2). С учетом этого запишем
и S. Момент импульса L=J∙w 2, где J — момент инерции цилиндра (J = m∙R 2); m — его масса; w 2 — угловая скорость внешнего цилиндра (w 2=2p∙ n 2). С учетом этого запишем
L=m∙R2×2p∙n2=2p∙m∙R2∙n2
Градиент скорости 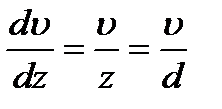 .Площадь цилиндра равна S=2p∙ R∙l.
.Площадь цилиндра равна S=2p∙ R∙l.
Подставив в (4) выражения L, 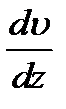 , S, получим
, S, получим
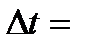
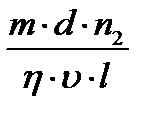 .
.
Заменив здесь υ по (1), найдем
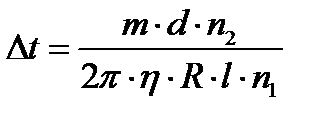 . (5)
. (5)
Динамическая вязкость воздуха h == 17,2 мкПа×с= 1,72∙10-5 Па∙с.
Подставив в (5) значения входящих в нее величин и произведя вычисления, получим
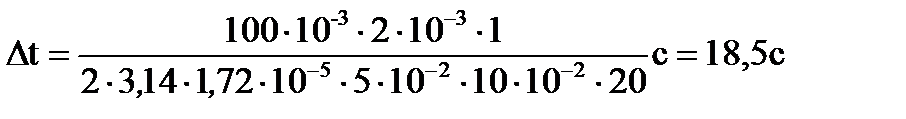 .
.
Пример 5. Найти среднюю кинетическую энергию одной молекулы аммиака NH3 при температуре t=27 °С и среднюю энергию вращательного движения этой молекулы при той же температуре.
Решение. Средняя полная энергия молекулы определяется по формуле
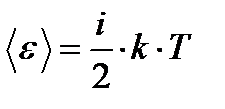 (1)
(1)
где i — число степеней свободы молекулы; k — постоянная Больцмана; Т— термодинамическая температура газа: T = t + Т 0, где Т 0=273 К.
Число степеней свободы i четырехатомной молекулы, какой является молекула аммиака, равно 6.
Подставим значения величин в (l):
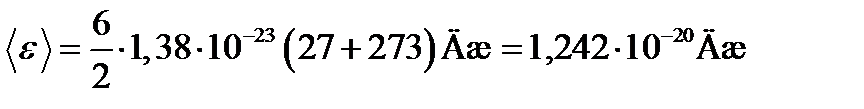 .
.
Средняя энергия вращательного движения молекулы определяется по формуле
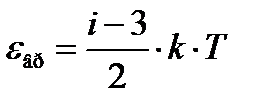 , (2)
, (2)
где число 3 означает число степеней свободы поступательного движения.
Подставим в (2) значения величин и вычислим:
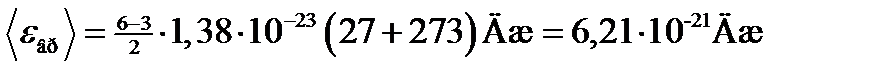 .
.
Заметим, что энергию вращательного движения молекул аммиака можно было получить иначе, разделив полную энергию (e) на две равные части. Дело в том, что у трех (и более) атомных молекул число степеней свободы, приходящихся на поступательное и вращательное движение, одинаково (по 3), поэтому энергии поступательного и вращательного движений одинаковы. В данном случае
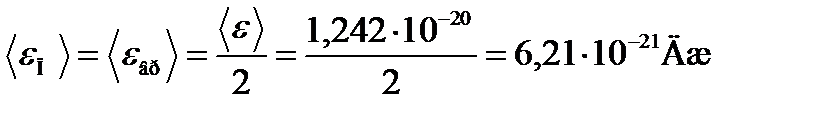
Пример 6. Пылинки массой m =10-18 г взвешены в воздухе. Определить толщину слоя воздуха, в пределах которого концентрация пылинок различается не более чем на 1 %. Температура Т воздуха во всём объеме одинакова и равна 300 К.
Решение. При равновесном распределении пылинок концентрация их зависит только от координаты z по оси, направленной вертикально. В этом случае к распределению пылинок можно применить формулу Больцмана
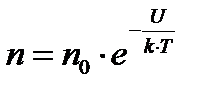 . (1)
. (1)
Так как в однородном поле силы тяжести U=m∙g∙z, то
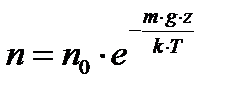 .(2)
.(2)
По условию задачи, изменение D n концентрации с высотой мало по сравнению с n (D n / n =0,01), поэтому без существенной погрешности изменение концентрации D n можно заменить дифференциалом d n.
Дифференцируя выражение (2) по z, получим
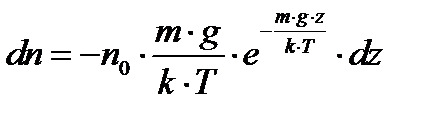 .
.
Так как 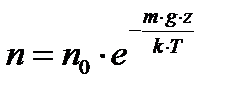 , то
, то
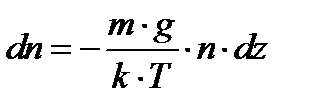 .
.
Отсюда находим интересующее нас изменение координаты:
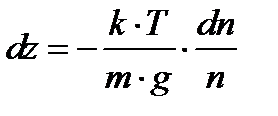 .
.
Знак минус показывает, что положительным изменениям координаты (dz>0) соответствует уменьшение относительной концентрации (dn<0). Знак минус опустим (в данном случае он несуществен) и заменим дифференциалы dz и dn конечными приращениями Dzи Dn:
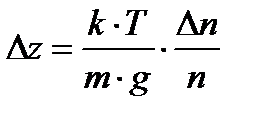 .
.
Подставим в эту формулу значения величин D n / n =0,01, k =1,38×10-23 Дж/К, T =300 К, m= 10-21 кг, g=9,81 м/с2 и, произведя вычисления, найдем
Dz=4,23 мм.
Как видно из полученного результата, концентрация даже таких маленьких пылинок (m == 10-18 г) очень быстро изменяется с высотой.
Пример 7. В сосуде содержится газ, количество вещества v которого равно 1,2 моль. Рассматривая этот газ как идеальный, определить число D N молекул, скоростиυ которых меньше 0,001 наиболее вероятной скорости υ в.
Решение. Для решения задачи удобно воспользоваться распределением молекул по относительным скоростям u (u = υ/υ в). Число d N (u) молекул, относительные скорости и, которых заключены в пределах от u до d u, определяется формулой
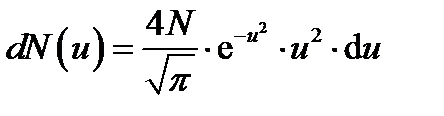 , (1)
, (1)
где N — полное число молекул.
По условию задачи, максимальная скорость интересующих нас молекул υ max=0,001 υ в, откуда u max= υ max/ υ в=0,001. Для таких значений и выражение (1) можно существенно упростить. В самом деле, для u «1 имеем е-2»1- u 2. Пренебрегая значением u 2 = (0,001)2=10-6 по сравнению с единицей, выражение (1) запишем в виде
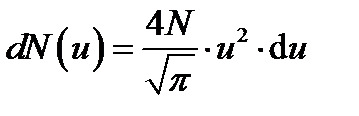 . (2)
. (2)
Интегрируя это выражение по и в пределах от 0 до u max, получим
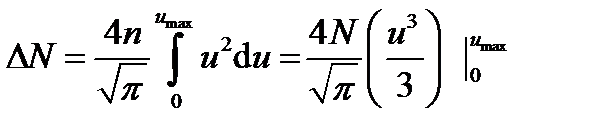 , или
, или 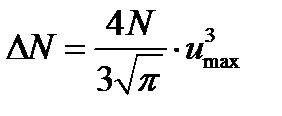 . (3)
. (3)
Выразив в (3) число молекул N через количество вещества и постоянную Авогадро, найдем расчетную формулу:
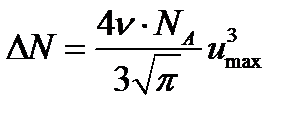 .(4)
.(4)
Подставим в (4) значения величин v, n aи произведем вычисления:
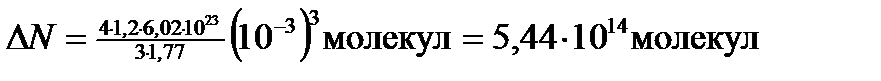 .
.
Пример 8. Зная функцию f (р) распределения молекул по импульсам, определить среднее значение квадрата импульса< p 2>.
Решение. Среднее значение квадрата импульса < p 2> можно определить по общему правилу вычисления среднего:
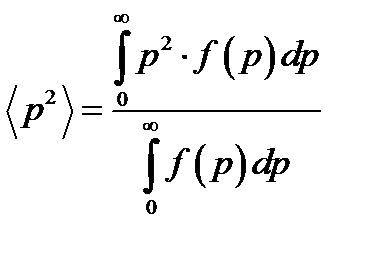 . (1)
. (1)
Функция распределения молекул по импульсам имеет вид
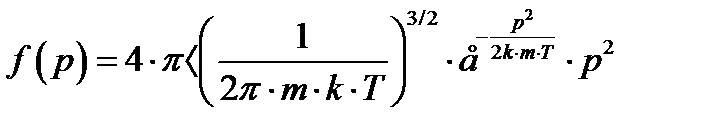 (2)
(2)
Эта функция распределения уже нормирована на единицу, т. е.
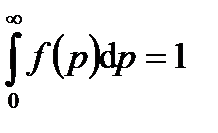 .
.
С учетом нормировки формулу (1) перепишем иначе:
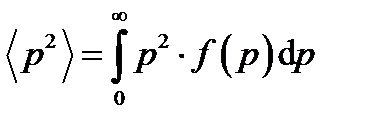 . (3)
. (3)
Подставим выражение f(p) по уравнению (2) в формулу (3) и вынесем величины, не зависящие от р, за знак интеграла:
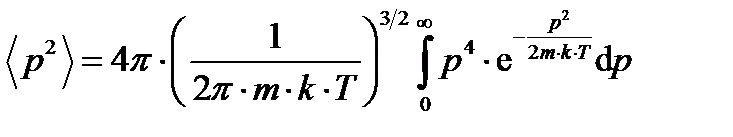 .
.
Этот интеграл можно свести к табличному.
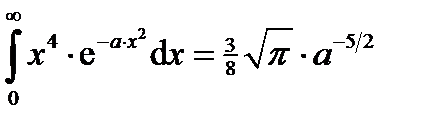 , положив
, положив 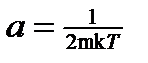 .
.
В нашем случае это даст
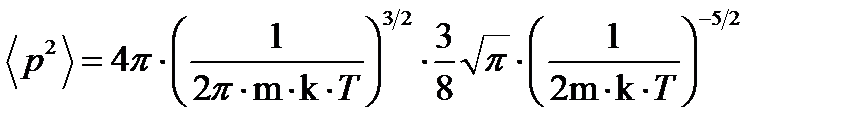 .
.
После упрощений и сокращений найдем
<p2>=3m∙k∙T.
Пример 9. Определить начальную активность А0 радиоактивного магния 27Mg массой m =0,2 мкг, а также активность А по истечении времени t =1 ч. Предполагается, что все атомы изотопа радиоактивны.
Решение. Начальная активность изотопа
А0= λ∙N 0 (1)
где λ — постоянная радиоактивного распада; N 0 — количество атомов изотопа в начальный момент (t =0).
 Если учесть, что
Если учесть, что

то формула (1) примет вид
Выразим входящие в эту формулу величины в СИ и произведем вычисления:
A 0=5,15×1012 Бк=5,15ТБк.
Активность изотопа уменьшается со временем по закону
A=A 0∙e-λ∙t (3)
Заменив в формуле (3) постоянную распада λ ее выражением, получим
A=A 0 e-ln2*t/T1/2 = A 0 (eln2)-t/T1/2
Так как eln2 = 2 окончательно будем иметь
A=A 0 /2t/T1/2
Сделав подстановку числовых значений, получим
A =8,05×1010Бк=80,5 ГБк.
Пример 10. При определении периода полураспада T1/2 короткоживущего радиоактивного изотопа использован счетчик импульсов. За время ∆ t = 1 мин в начале наблюдения (t= 0) было насчитано ∆ n 1=250 импульсов, а по истечении времени t =1 ч - ∆ n 2=92 импульса. Определить постоянную радиоактивного распада λ и период полураспада T1/2 изотопа.
Решение. Число импульсов ∆ n, регистрируемых счетчиком за время ∆ t, пропорционально числу распавшихся атомов ∆ N.
Таким образом, при первом измерении
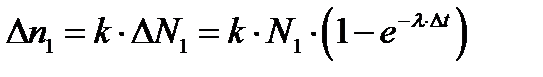 , (1)
, (1)
где N 1 — количество радиоактивных атомов к моменту начала отсчета; k — коэффициент пропорциональности (постоянный для данного прибора и данного расположения прибора относительно радиоактивного изотопа).
При повторном измерении (предполагается, что расположение приборов осталось прежним)
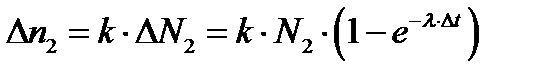 , (2)
, (2)
где N 2 — количество радиоактивных атомов к моменту начала второго измерения.
Разделив соотношение (1) на выражение (2) и приняв во внимание, что по условию задачи ∆ t одинаково в обоих случаях, а также что N 1 и N 2. связаны между собой соотношением N 2 = N 1 ∙ e-λt, получим
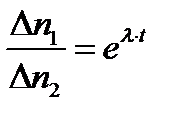 (3)
(3)
где t — время, прошедшее от первого до второго измерения. Для вычисления l выражение (3) следует прологарифмировать: ln(∆ n 1/∆ n 2)= λ∙t, откуда
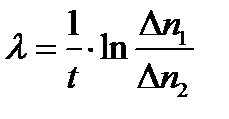 .
.
Подставив числовые данные, получим постоянную радиоактивного распада, а затем и период полураcпада:
λ = (1/1)×ln(250/92)ч-1 = 1ч-1;
T 1/2 = ln2/λ = 0,693/1 = 0,693ч = 41,5 мин.
 2015-01-07
2015-01-07 1940
1940
