б) Устойчивость уксусной кислоты к окислителям
В пробирке к 1 мл раствора уксусной кислоты прибавить 0,5 мл раствора перманганата калия. Обесцвечивания раствора не происходит, что указывает на устойчивость кислоты к действию окислителей.
в) Разложение ацетата натрия до ацетона
Сухой ацетат натрия массой 2 – 3 г выносят в пробирку и нагревают в пламени спиртовки. Происходит разложение соли с образованием ацетона и карбоната натрия. К охлажденному продукту реакции прибавляют 1 – 2 мл 10%-ного раствора соляной кислоты и наблюдают вскипание смеси в результате образования углекислого газа:
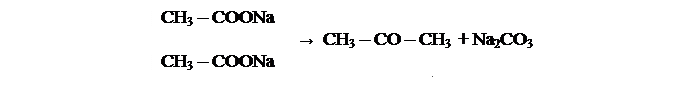
и далее Na2CO3 + 2 HCl → 2 NaCl + CO2↑ + H2O
7. Свойства высших жирных кислот
а) При нагревании в пробирке смеси из 1 г твердого мыла и 8 – 10 мл воды происходит его растворение. К полученному раствору прибавляют 3 – 4 мл 5%-ного раствора серной кислоты, при этом выделяется осадок нерастворимых высших жирных кислот:
С15H31COONa + H2SO4 → С15H31COOH ↓ + NaHSO4
б) Образование нерастворимых солей высших жирных кислот
В пробирку вносят 1 мл раствора мыла и прибавляют несколько капель 10%-ного раствора хлорида кальция. Наблюдается образование осадка при протекании реакции:
2 C17H35COONa + CaCl2 → (C17H35COO)2Ca ↓ + 2 NaCl
В другую пробирку, содержащую 3 мл раствора мыла прибавляют 0,5 – 1 мл раствора нитрата свинца. Образуется нерастворимая в воде соль по реакции:
2 C17H35COONa + Pb(NO3)2 → (C17H35COO)2Pb ↓ + 2 HNO3
в) Гидролиз мыла
В сухую пробирку вливают спиртовый раствор мыла и несколько капель раствора фенолфталеина. К полученной смеси медленно прибавляют воду. В растворе появляется малиновая окраска, что указывает на щелочную среду раствора как результат реакции гидролиза:
C17H35COONa + НОН ⇄ C17H35COOН + Na + + OH –
8. Свойства непредельных карбоновых кислот
а) Взаимодействие олеиновой кислоты с бромом
В пробирку наливают 1 – 2 мл олеиновой кислоты, прибавляют 4 – 5 мл бромной воды и смесь встряхивают. Происходит обесцвечивание бромной воды в реакции образования дибромстеариновой кислоты:
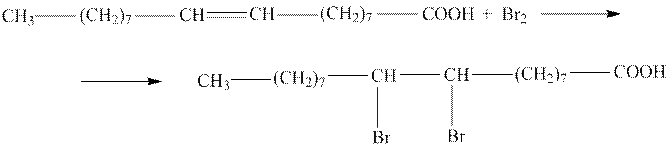
б) Окисление олеиновой кислоты
В пробирку приливают 1 – 2 мл олеиновой кислоты и добавляют 2 – 3 мл щелочного раствора перманганата калия. Раствор обесцвечивается в результате реакции образования диоксистеариновой кислоты и бурого осадка диоксида марганца.
9. Свойства дикарбоновых кислот
а) В сухую пробирку внести кристаллическую щавелевую кислоту:
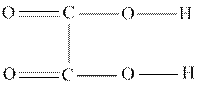
Закрыть пробирку пробкой с газоотводной трубкой, конец которой опущен в пробирку с баритовой водой. При нагревании наблюдать помутнение баритовой воды. Реакция разложения щавелевой кислоты при нагревании происходит с образованием угольного ангидрида и муравьиной кислоты, которая в свою очередь, разлагается на углекислый газ и воду.
б) В пробирку вносят 2 мл насыщенного раствора щавелевой кислоты и 3 – 4 мл подкисленного раствора перманганата калия. Смесь осторожно нагревают. Происходит обесцвечивание раствора в реакции окисления щавелевой кислоты:
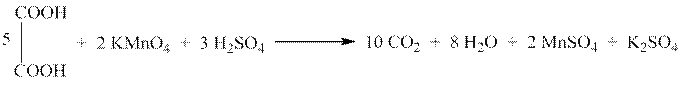
10. Свойства оксикислот
а) В пробирку вносят 3 – 4 мл 1 н. раствора винной кислоты, далее прибавляют 2 мл раствора гидроксида калия. Идет реакция с образованием гидротартрата калия:
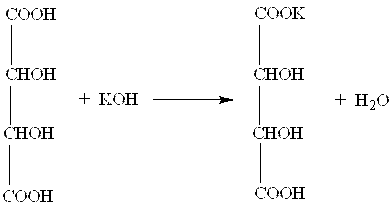
Если скорость выпадения осадка низкая, то следует потереть стенки пробирки стеклянной палочкой.
При последующем прибавлении щелочи образуется растворимая в воде средняя соль – тартрат калия:
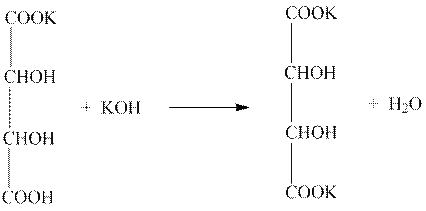
б) В пробирке к 2 – 3 мл 1%-ного раствора винной кислоты прибавить 10%-ный раствор гидроксида натрия до сильнощелочной реакции. К полученной смеси прибавить по каплям 2%-ный раствор медного купороса, что приводит к образованию голубого осадка гидрокисда меди (II), который при взбалтывании растворяется. Раствор приобретает темно-синий цвет вследствие образования растворимых комплексных соединений типа алкоголятов многоатомных спиртов.
 2015-01-07
2015-01-07 4873
4873