Цель работы: ознакомление с понятием эквивалента вещества и методикой расчета, связанной с законом эквивалентов.
Количества элементов, входящих в состав химических соединений, находятся между собой в определённых и постоянных отношениях (закон постоянства состава). Эти отношения соответствуют их эквивалентам, т.е. с одним эквивалентом любого элемента соединяется один эквивалент другого элемента. В этом состоит суть закона эквивалентов. Эквивалент элемента – это такое его количество, которое может при химических реакциях присоединять или замещать 1 моль атомов водорода или ½ моль атомов кислорода. Масса одного эквивалента, выраженная в граммах, называется эквивалентной массой (mЭ) или молярной массой эквивалента. Молярная масса эквивалента водорода mЭ = 1 г, молярная масса эквивалента кислорода mЭ = 8 г. Эквивалентным объёмом называется объём, который занимает при данных условиях 1 эквивалент рассматриваемого вещества.
Например, при нормальных условиях эквивалентный объём водорода равен 11,2 л, эквивалентный объём кислорода – 5,6 л.
При экспериментальном определении эквивалента следует учесть, что согласно закону эквивалентов все вещества взаимодействуют между собой в количествах, пропорциональных их эквивалентам, т.е. с одним эквивалентом какого-либо элемента или вещества взаимодействует один эквивалент другого элемента или вещества. Соответственно, с одной эквивалентной массой или одним эквивалентным объёмом какого-либо вещества взаимодействует одна эквивалентная масса или один эквивалентный объём другого вещества. Так, например, один эквивалент металла вытесняет из кислоты 11,2 л водорода (н.у.). Экспериментальное определение эквивалентов элемента может быть проведено различными методами.
1. Метод прямого определения.
Находят массовое количество элемента, соединяющееся с 1,008 г/моль водорода или с 8 г/моль кислорода.
Пример. При окислении 8,71 г металла получено 9,71 г оксида. Эквивалентная масса металла определяется из простого соотношения:
на 8,71г металла пошло (9,71 – 8,71) г кислорода
Э г/моль –“ – - 8 г/моль –“–
Тогда Э = 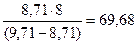 г/моль
г/моль
2. Метод вытеснения.
Если элемент вытесняет водород, то эквивалент его может быть определён по количеству выделенного водорода на единицу массы затраченного металла.
3. Электрический метод.
Химические эквиваленты элементов определяются на основе закона Фарадея, согласно которому 96500 Кл электричества выделяют из электролита один эквивалент вещества.
 2015-01-07
2015-01-07 3525
3525








