Определение теплоты растворения соли
Растворение кристаллических солей представляет собой сложное физико-химическое явление. При растворении кристаллической соли в воде происходят два основных процесса:
1) эндотермический, связанный с разрушением кристаллической решётки;
2) экзотермический, обусловленный взаимодействием частиц растворяемого вещества с молекулами растворителя и образованием гидратированных ионов.
В зависимости от того, какой из двух вышеупомянутых тепловых процессов преобладает, тепловой эффект растворения может быть величиной или положительной или отрицательной.
При практическом определении теплоты растворения устанавливают количество тепла, поглощающегося или выделяющегося при растворении произвольно выбранной навески определяемого вещества. Так как количество тепла пропорционально количеству растворённого вещества, то в дальнейшем полученное количество тепла пересчитывают на один моль растворённого вещества.
Определяют теплоту растворения с помощью специального прибора – калориметра. Определённое количество воды помещают в калориметр и измеряют её температуру. Растворяют в ней точно взвешенное количество какого-либо вещества и измеряют максимальную температуру раствора.
В зависимости от характера процесса и реагирующих веществ применяют калориметры различных конструкций, но все калориметры содержат калориметрический сосуд, который защищает от потерь тепла и снабжён чувствительный ртутными термометрами или другим устройством для измерения температуры.
Простейший калориметр представлен на рис.3. Систему из двух стаканов можно заменить сосудом Дьюара.
Проведение опыта
Вынуть внутренний стакан калориметра, взвесить на технохимических весах, налить в него около 200 мл воды и снова взвесить. Взять сухую соль (нитрат аммония), тщательно растереть в ступке, насыпать её в сухую пробирку, примерно на 1/3 её высоты, и закрыть пробкой. Пробирку с солью взвесить и вставить в калориметр так, чтобы нижняя часть пробирки, заполненная солью, была погружена в воду калориметра.
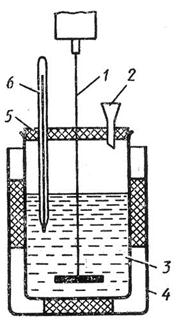
Рисунок 3. Калориметр
Через 5–10 минут, перемешав воду мешалкой, измерить с точностью до 0,10 температуру Т1 воды в калориметре.
Вынуть пробирку из калориметра и высыпать её содержимое во внутренний стакан калориметра с водой. Закрыв отверстие в крышке калориметра пробкой, перемешать жидкость до полного растворения соли и измерить минимальную температуру Т2 раствора.
По окончании опыта пробирку с пробкой и остатками соли тщательно обтереть снаружи и снова взвесить. Определите по разности массу растворённой соли.
Далее записываются результаты опыта:
| масса сухого стакана m1 , г | |
| масса стакана с водой m2 , г | |
| масса воды в стакане m = m2 – m1 | |
| масса пробирки с пробкой и солью m3, г | |
| масса пробирки с пробкой m4, г | |
| масса растворённой соли m/ = m4 – m3 | |
| температура воды Т1 | |
| температура раствора Т2 | |
| разность температур ΔТ = Т2 – Т1 | |
| Молекулярная масса растворённого вещества М |
Определяем теплоту растворения нитрата аммония по формуле:
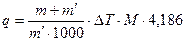 кДж/моль
кДж/моль
Рассчитать относительную ошибку опыта.
Определение теплоты нейтрализации.
Работу проводить в калориметре (см. рис. 3). В сухой внутренний стакан калориметра налить из бюретки 100 мл 1 н. раствора едкого натра. В другой сухой стакан налить 100 мл 1 н. раствора кислоты. Измерить с точностью до 0,10 температуры Т1 кислоты и щёлочи. Если температура растворов различна, выдержать их до одинаковой температуры. Затем быстро через воронку влить кислоту в раствор щёлочи и, перемешав раствор мешалкой, измерить максимальную температуру с той же точностью, Т2.
По данным рассчитать количество тепла, выделяющегося при реакции, по формуле:
q = V∙d∙ΔT∙с∙4,186 кДж.
где V – объём раствора после нейтрализации,
d – плотность раствора,
с – теплоёмкость раствора,
ΔT – разность температур.
Для простоты расчёта следует применять плотность раствора после нейтрализации за единицу, а его теплоёмкость равной теплоёмкости воды. Далее составить уравнение нейтрализации и рассчитать тепловой эффект нейтрализации грамм-эквивалента кислоты, а затем определить относительную ошибку опыта.
Вопросы и задачи.
1.Что называется теплотой образования химического соединения?
2. Привести примеры применения закона Гесса для химических реакций, протекающих через промежуточные стадии.
3. Определите стандартную теплоту образования сероуглерода СS2, если известно, что CS2 (ж) + 3 O2 = CO2 (г) + 2 SO2 (г) – 1075 кДж/моль.
4. При взаимодействии 5 г металлического натрия с водой выделяется 40,25 кДж теплоты, а при взаимодействии 10 г оксида натрия с водой выделяется 36,46 кДж теплоты. Рассчитайте ΔН0298 Na2O.
5. Вычислите стандартную теплоту образования сахарозы С12Н22О11, если тепловой эффект реакции С12Н22О11 + 12 О2 = 12 СО2 + 11 Н2О(ж) равен – 5694 кДж.
6. Вычислить тепловой эффект реакции Al2O3 (к) + 3 SO3 (г) = Al2(SO4)3 (к), если известны стандартные теплоты образования реагирующих веществ.
7. По стандартным теплотам сгорания веществ рассчитайте Δ Н0298 системы
С2Н5ОН (ж) + СН3СООН (ж) = СН3СООС2Н5 (ж) + Н2О
и Δ Н0сгор. (СН3СООС2Н5) = – 2254,21 кДж/моль. Конечные продукты сгорания – газообразный СО2 и жидкая Н2О.
8. Определите тепловой эффект реакции: 2 PbS(к) + 3 O2 (г) = 2 PbO(к) + 2 SO2 (г)
используя значение стандартных теплот образования реагирующих веществ.
9. Определите ΔU при испарении 100 г воды при 20 0С, допуская, что пары воды подчиняются законам идеальных газов и что объём жидкости незначителен по сравнению с объёмом пара. Удельная теплота парообразования воды 2451 Дж/г.
10. Разложение хлората калия протекает по уравнению:
КClO3(к) = KCl(к) + 1,5 O2 (г)
Какое количество тепла выделилось, если объём кислорода после окончания реакции равен 2,24 л?
11. Возможна ли следующая реакция: 2 Hg2Cl2 = 2 HgCl2 + 2 Hg.
Ответ подтвердите, рассчитав ΔG0298 этой системы.
12. Какая из приведённых реакций разложения KNO3 наиболее вероятна:
а) KNO3 = K + NO2 + ½ O2;
б) 2 KNO3 = K2O + 2 NO2 + O2
в) KNO3 = KNO2 + ½ O2.
13. Определите знак изменения энтропии для реакции
2 А2 (г) + В2 (г) = 2 А2В(ж).
Возможно ли протекание этой реакции в стандартных условиях? Ответ обосновать.
14. Можно ли получить серный ангидрид по реакции
CaSO4 (к) + CO2 (г) = CaCO3 (к) + SO3 (г)?
Работа № 4
 2015-01-07
2015-01-07 3198
3198








