Цель работы: выполнение калориметрических измерений и термодинамических расчетов, связанных с энергетикой химических реакций.
При химических реакциях происходит не только изменение химического состава вещества, но и, одновременно, изменение запаса химической энергии системы. К важнейшим величинам, характеризующим химические системы, относятся: внутренняя энергия системы U, энтальпия Н, энтропия S и энергия Гиббса (изобарно-изотермический потенциал) G. Все эти величины представляют собой функции состояния, т.е. зависят только от состояния системы, но не от способа, которым это состояние достигнуто.
Любые энергетические изменения в химической системе подчиняются закону сохранения энергии
Q =  U + A,
U + A,
где Q – теплота, подведённая к системе, затрачиваемая на изменение внутренней энергии системы  U и совершение работы А.
U и совершение работы А.
Внутренняя энергия системы U складывается из энергии движения молекул, атомов и электронов системы, кроме кинетической и потенциальной энергии системы в целом. Абсолютную величину внутренней энергии определить невозможно, и в этом нет практической необходимости, т.к. человечество в своей деятельности имеет дело только с изменениями энергии при переходе системы из одного состояния в другое.
Если вследствие химического изохорного процесса (V = const) выделяется теплота, то это выделение теплоты соответствует убыли энергии системы. Эта убыль обозначается – 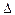 U. Поглощение же теплоты в изохорном процессе соответствует приросту внутренней энергии системы. Выделение теплоты в изобарном процессе соответствует увеличению энтальпии и обозначается –
U. Поглощение же теплоты в изохорном процессе соответствует приросту внутренней энергии системы. Выделение теплоты в изобарном процессе соответствует увеличению энтальпии и обозначается –  Н; поглощение теплоты в изобарном процессе соответствует увеличению энтальпии и обозначается +
Н; поглощение теплоты в изобарном процессе соответствует увеличению энтальпии и обозначается +  Н. Значение Q,
Н. Значение Q,  U,
U,  H выражаются в одних и тех же единицах (калориях или джоулях; 1 Дж = 0,239 кал).
H выражаются в одних и тех же единицах (калориях или джоулях; 1 Дж = 0,239 кал).
Реакции, протекающие с выделение теплоты, называются экзотермическими, а реакции, протекающие с поглощением теплоты из окружающей среды, – эндотермическими.
Количество тепла, выделяемое или поглощаемое при химических реакциях, называются тепловым эффектом реакции.
Химические уравнения, в которых указывается тепловой эффект реакции, называются термохимическими уравнениями.
В основе изучения термохимических процессов лежит закон Гесса: тепловой эффект химической реакции (т.е. изменение энтальпии или внутренней энергии системы в результате реакции) зависит только от начального и конечного состояния участвующих в реакции веществ и не зависит от промежуточных стадий процесса.
В термохимических расчётах часто используют понятия «теплота образования» и «теплота сгорания» вещества. Теплотой образования называют тепловой эффект реакции образования 1 моля сложного вещества из простых веществ. Теплоты образования обычно приводят для стандартных условий (Р = 1 атм, Т = 298 К) и обозначают  Н0298 или
Н0298 или  Н0 (см. табл. 4 приложения). Теплоты образования простых веществ при стандартных условиях принимаются равными нулю.
Н0 (см. табл. 4 приложения). Теплоты образования простых веществ при стандартных условиях принимаются равными нулю.
Из закона Гесса суммарный тепловой эффект равен сумме тепловых эффектов отдельных стадий:  Н1 =
Н1 =  Н2 +
Н2 +  Н3.
Н3.
Пример1. Рассчитайте теплоту образования жидкого тетрахлорида TiCl4 по данным для других термохимических уравнений:
Ti (к) + 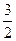 Cl2 (г) = TiCl3 (к) + 172,4 ккал (a)
Cl2 (г) = TiCl3 (к) + 172,4 ккал (a)
TiCl3 (к) + 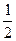 Cl2 (г) = TiCl4 (ж) + 19,9 ккал (б).
Cl2 (г) = TiCl4 (ж) + 19,9 ккал (б).
Решение.
Складываем почленно уравнения (а) и (б).
Ti (к)+ 2Cl2 (г) = TiCl4 (ж) + 192,3 ккал.
Следовательно,  Н0298 = –192,3 ккал/моль (–803,8 кДж/моль).
Н0298 = –192,3 ккал/моль (–803,8 кДж/моль).
Из законов Гесса вытекает очень важное следствие, применение которого упрощает многие термохимические расчёты: стандартное изменение энтальпии химической реакции равно сумме стандартных энтальпий образования продуктов реакции за вычетом суммы стандартных энтальпий образования исходных веществ.
Пример 2. Пользуясь данными таблицы 4 приложения, вычислить  Н0 реакции.
Н0 реакции.
2 Mg (к) + CO2 (г) = 2 MgO (к) + C (графит)
Решение.
По данным табл.4 стандартные энтальпии образования СО2 (г) и MgO (к) равны, соответственно –393,5 и –601,8 кДж/моль.
Отсюда, для стандартной энтальпии реакции находим
 Н0 = 2
Н0 = 2  Н0 (MgO) –
Н0 (MgO) –  H0 (CO2) = 2∙(–601,8) – (–393,5) = –810,1 кДж.
H0 (CO2) = 2∙(–601,8) – (–393,5) = –810,1 кДж.
Внутренняя энергия и энтальпия системы связаны соотношением
 U =
U =  H -
H -  nRT.
nRT.
Для определения направления обратимых химических процессов, константы равновесия и других термодинамических величин помимо энтальпии необходимы и другие функции состояния системы: энтропия S и энергия Гиббса G. Энтропия является мерой неупорядоченности системы и равна:
S = 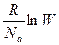 ,
,
где R – универсальная газовая постоянная,
Nа – число Авогадро,
W – вероятность состояния вещества, т.е. число микросостояний, с помощью которого осуществляется данное микросостояние системы.
Самопроизвольное протекание химического процесса связано с увеличением энтропии.
Таким образом, мы видим, что самопроизвольное протекание химического процесса зависит от стремления системы:
а) к переходу в состояние с наименьшей внутренней энергией, мерой этого фактора является изменение энтальпии: –  Н указывает на уменьшение, а +
Н указывает на уменьшение, а +  Н – на возрастание энтальпии системы;
Н – на возрастание энтальпии системы;
б) к беспорядку, к достижению наиболее вероятного состояния, которое может быть реализовано наибольшим числом равновероятных способов, мерой этого фактора является энтропия. Энтропия возрастает при переходе вещества из кристаллического состояния в жидкое, и из жидкого в газообразное.
Энергия Гиббса  G является функцией состояния, которая одновременно отражает влияние энтальпии и энтропии на направление протекания химических процессов, и связана с ним отношением:
G является функцией состояния, которая одновременно отражает влияние энтальпии и энтропии на направление протекания химических процессов, и связана с ним отношением:
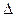 G =
G =  H -
H -  ST,
ST,
где Т – абсолютная температура.
При постоянстве температуры и давления химические реакции могут самопроизвольно протекать только в таком направлении, при котором энергия Гиббса системы уменьшается ( G < 0).
G < 0).
Величины  G, так же как и
G, так же как и  Н, для простых веществ принимают равными нулю. Энтропии Δ S0 простых веществ не равны нулю. Энергию Гиббса, энтропию и энтальпию можно рассчитывать по закону Гесса и следствиям из него.
Н, для простых веществ принимают равными нулю. Энтропии Δ S0 простых веществ не равны нулю. Энергию Гиббса, энтропию и энтальпию можно рассчитывать по закону Гесса и следствиям из него.
Пример 3. Определите изменение внутренней энергии при испарении 250 г воды при 20 0С, допуская, что пары воды подчиняются законам идеальных газов. Объёмом жидкости, по сравнению с объёмом пара, можно пренебречь. Удельная теплота парообразования воды  Н = 2451Дж/г.
Н = 2451Дж/г.
Решение.
 U =
U =  H -
H -  nRT.
nRT.
Число молей воды равно:
 n = 250/18 = 13,87 моль
n = 250/18 = 13,87 моль
R = 8,314 Дж/(моль∙К).
При определении изменения внутренней энергии учитывается общая масса испаряющейся воды (250г):
 U = 2451 ∙ 250 – 13,87 ∙ 8,3144 ∙ 293 = 579,0 кДж.
U = 2451 ∙ 250 – 13,87 ∙ 8,3144 ∙ 293 = 579,0 кДж.
Внутренняя энергия увеличилась на 579,0 кДж.
Пример 4. Возможна ли следующая реакция:
SiO2 (к) + 2 NaOH (р) 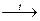 Na2SiO3 (к) +H2O (ж),
Na2SiO3 (к) +H2O (ж),
если 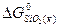 = – 803,75 кДж/моль;
= – 803,75 кДж/моль;
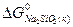 = – 1427,8 кДж/моль;
= – 1427,8 кДж/моль;
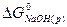 = – 419,5 кДж/моль;
= – 419,5 кДж/моль;
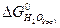 = – 237,5 кДж/моль?
= – 237,5 кДж/моль?
Можно ли выпаривать щёлочь в стеклянном сосуде?
Решение.
Изменение энергии Гиббса  G0298 реакции равно:
G0298 реакции равно:
 G0298 = Σ
G0298 = Σ  G0прод.реакций –
G0прод.реакций –  ΣΔG0исход. веществ;
ΣΔG0исход. веществ;
 G0298 = (–1427,8 – 237,5) – (–803,75 – 419,5 ∙ 2) = – 22,55 кДж;
G0298 = (–1427,8 – 237,5) – (–803,75 – 419,5 ∙ 2) = – 22,55 кДж;
 G0298 = – 22,55 кДж (т.е.
G0298 = – 22,55 кДж (т.е.  G0 < 0), а следовательно, данная реакция возможна. Щелочь нельзя выпаривать в стеклянном сосуде, так как в состав стекла входит SiO2.
G0 < 0), а следовательно, данная реакция возможна. Щелочь нельзя выпаривать в стеклянном сосуде, так как в состав стекла входит SiO2.
 2015-01-07
2015-01-07 3259
3259
