Вариант (а)
Определение молярной массы эквивалента цинка методом вытеснения водорода.
В настоящей работе каждому студенту выдаётся взвешенный кусочек цинка, эквивалент которого нужно определить.
Прибор для определения химического эквивалента изображён на рис.2.
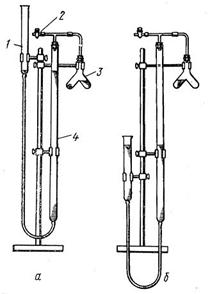
Рисунок 2. Прибор для определения химического эквивалента
Прибор состоит из следующих частей: бюретки на 50 мл (4), двухколенной пробирки (3), открытой трубки, служащей в качестве уравнительного сосуда (1), стеклянного крана (2) (кран можно заменить зажимом).
В уравнительный сосуд залейте воду, которая заполнит бюретку и вытеснит из прибора избыток воздуха через открытый кран (2). Бюретку укрепите на штативе так, чтобы уровни воды в бюретке и открытой трубке совпадали с нулевым делением. Для удобства отсчётов бюретку целесообразно опустить так, чтобы нулевое деление было на уровне глаз наблюдателя. Отсчёты уровня жидкости делайте по нижнему уровню (краю) мениска.
Кусочек цинка поместите в одно из колен пробирки, в другое колено пробирки налейте из маленького мерного цилиндра 24 %-ный раствор соляной кислоты.
Перед началом реакции проверьте прибор на герметичность. Для этого плотно вставьте пробки и закройте кран тройника, уравнительный сосуд снимите с держателя и опустите вниз на 15-20 см. Уровень воды в бюретке несколько снизится и останется без изменения, если прибор герметичен. При возвращении сосуда на прежнее место вода в нём и в бюретке должна быть на том же уровне (нулевом). Проверните пробирку таким образом, чтобы жидкость перелилась в то колено, где находится цинк. Реакция идёт по уравнению:
Zn + 2 HCl = ZnCl2 + H2,
Пока идёт реакция, зарисуйте в свой тетради установку и запишите показания барометра – Ратм и термометра – t 0C. В конце реакции передвижением сосуда приведите воду в бюретке и в сосуде к одинаковому уровню (зачем?). После охлаждения пробирки отметьте и запишите уровень воды в бюретке.
Результаты измерений запишите в таблицу:
| Масса цинка mZn, г | |
Объём вытесненного газа 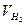 , мл , мл | |
| Давление Ратм, мм рт. ст. | |
| Температура t, 0С | |
| Давление насыщенного водяного пара при температуре t, мм рт. ст. |
Вычислите массу вытесненного водорода 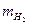 , пользуясь уравнением Менделеева-Клайперона:
, пользуясь уравнением Менделеева-Клайперона:
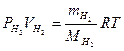 ,
,
где 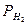 – парциальное давление водорода, мм рт. ст.
– парциальное давление водорода, мм рт. ст.
Из закона эквивалентов выразите ЭZn:
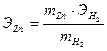
Вычислите абсолютную и относительную ошибки:
Аб. ошибка = Этеор – Ээксп,
где 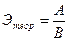
Отн. ошибка = 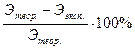
Вариант (б)
Последовательность выполнения работы.
1. Возьмите на химико-технических весах навеску металлического цинка – 0,1г.
2. Подготовьте трубку для собирания газа:
а) наполните её с помощью воронки водой;
б) закройте пальцами, опрокиньте в кристаллизатор с водой и закрепите на штативе.
3. Подготовьте пробирку с газоотводной трубкой для получения водорода, для этого:
а) подведите конец газоотводной трубки к трубке для собирания газа закрепляемой на штативе,
б) заполните 1/3 пробирки 15 %-ной соляной кислотой и бросьте в неё навеску металлического цинка.
4. Быстро закройте отверстие пробирки пробкой с газоотводной трубкой и соберите выделяющийся водород, доведя растворение цинка до конца.
5. Собрав выделяющийся газ, измерьте высоту столба воды, оставшейся в трубке, с помощью полоски миллиметровой бумаги. Высота измеряется от уровня воды в кристаллизаторе. Выразите давление столба воды в мм.рт.ст., для чего получаемое в миллиметрах значение высоты разделите на 13,6.
6. Запишите величину атмосферного давления во время опыта.
7. В таблице «Давление насыщенных водяных паров» найдите парциальное давление водяного пара в газовой смеси при комнатной температуре.
8. По данным опыта вычислите парциальное давление водорода.
9. Определите объём полученного водорода по делениям трубки для собирания газа.
10. Запишите температуру выделившегося водорода, приняв её равной комнатной температуре.
11. Вычислите массу водорода по уравнению Менделеева – Клапейрона.
12. На основании полученных данных рассчитайте эквивалент цинка.
13. Определите табличный эквивалент цинка.
14. Найдите абсолютную и относительную ошибку опыта.
Форма отчета.
1. Укажите название темы и подтемы.
2. Сделайте рисунок «Установка для определения химического эквивалента цинка». (Рисунок должен изображать установку в момент окончания растворения цинка).
3. Данные опыта для определения химического эквивалента цинка приведите в таблице.
Данные опыта по определению эквивалента цинка.
| 1. | Навеска цинка mZn, г. | |
| 2. | Объём водорода 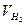 , мл. , мл. | |
| 3. | Высота столба воды, оставшейся в бюретке h, мм | |
| 4. | Давление столба воды, оставшейся в бюретке 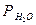 , мм рт. ст. , мм рт. ст. | |
| 5. | Атмосферное давление Pатм, мм рт. ст. | |
| 6. | Парциальное давление паров воды 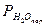 , мм рт. ст. , мм рт. ст. | |
| 7. | Парциальное давление водорода 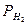 , мм рт. ст. , мм рт. ст. | |
| 8. | Масса водорода 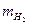 , г , г | |
| 9. | Эквивалент цинка, рассчитанный по табличной атомной массе (Этабл .) | |
| 10. | Эквивалент цинка, вычисленный по данным опыта (Эоп). | |
| 11. | Абсолютная ошибка определения (Аабс). | |
| 12. | Относительная ошибка определения (Аотнос .). |
К таблице приложите:
1. Формулу для вычисления массы водорода и схему расчёта массы водорода по данным опыта.
2. Схему вычисления эквивалента цинка по определённой массе водорода.
3. Нахождение абсолютной и относительной ошибок опыта.
Определение молярной массы эквивалента сложного вещества.
Одно и тоже вещество может иметь разные эквиваленты в различных реакциях, в зависимости от условий их проведения, что особенно характерно для реакций окисления-восстановления.
Эквивалент соли, основания или кислоты в реакциях обмена равен мольной массе, делённой на суммарную зарядность (заряд, выраженный в единицах элементарного заряда – катиона или аниона).
Э = М/кz,
где М – мольная масса вещества.
к – число атомов катиона в молекуле.
z – зарядность катиона.
Эквивалент вещества в реакциях окисления-восстановления равен его мольной массе, делённой на число принятых или отданных молекулой электронов n:
Э = М/n.
Понятие эквивалента сложного вещества широко используется в различных расчётах, особенно в области аналитической химии.
Очевидно, для нахождения величины эквивалента надо составить уравнение химической реакции, в которой участвует вещество, и с учётом уравнения реакции произвести вычисления.
Эквивалент многих сложных соединений определяется в растворах. В этом случае для определения эквивалента одного вещества по другому целесообразно пользоваться концентрациями: нормальностью и титром.
Нормальная концентрация (N) – это количество грамм-эквивалентов вещества, растворённого в 1 л раствора.
Количество растворенного вещества в граммах, содержащееся в 1 мл раствора, называют титром раствора – Т.
Нормальность N, эквивалентная масса Э и титр Т связаны соотношением 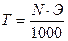 .
.
Раствор с известным титром называется титрованным.
Если необходимо определить величину эквивалента кислот, то определённое количество кислоты титруют раствором щёлочи, нормальность которого известна. Для этого к раствору кислоты постепенно приливается раствор щёлочи. Точку эквивалентности (когда число эквивалентов кислоты равно числу эквивалентов щёлочи) определяют с помощью индикатора (метил-оранжа или фенолфталеина). В соответствии с законом эквивалентов в точке эквивалентности числа миллиграмм-эквивалентов щёлочи и кислоты будут равны произведениям соответствующих объёмов на нормальность
Vщёлочи ∙ Nщёлочи = Vкислоты ∙Nкислоты
 2015-01-07
2015-01-07 2813
2813








