Опыт 1. Влияние концентрации веществ на химическое равновесие.
При взаимодействии трихлорида железа FeCl3 с роданидом аммония NH4SCN образуется малодиссоциированный трироданид железа Fe(SCN)3, который имеет характерный красный цвет. Реакция обратима:
FeCl3 + 3 NH4SCN 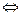 Fe(SCN)3 + 3 NH4Cl
Fe(SCN)3 + 3 NH4Cl
по изменению интенсивности окраски можно судить об изменении концентрации Fe(SCN)3 , т.е. о смещении равновесия в ту или иную сторону.
В четыре пробирки внесите 7 - 10 капель разбавленных растворов трихлорида железа FeCl3 и роданида аммония NH4SCN. Легким встряхиванием пробирок размешайте растворы. Поставьте все пробирки в штатив.
Одну пробирку с полученным раствором сохранить для сравнения результатов опыта. В остальные пробирки добавить следующие реактивы:
в первую – 1 - 2 капли насыщенного раствора трихлорида железа;
во вторую – 1 - 2 капли насыщенного раствора роданида аммония;
в третью – несколько кристалликов хлорида аммония.
Сравните интенсивность окраски полученных растворов с интенсивностью окраски эталона.
При оформлении отчета: отметьте изменение интенсивности окраски в каждом случае; запишите уравнение реакции между FeCl3 и NH4SCN и выражение константы равновесия данной реакции.
В каком направлении смещается равновесие и как изменится концентрация каждого компонента в случае добавления: а) трихлорида железа; б) роданида аммония; в) хлорида аммония?
Опыт 2. Влияние температуры на химическое равновесие.
Влияние температуры на химическое равновесие изучается на примере обратимой реакции:
2 NO2 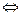 N2O4, ΔН = –54,4кДж/моль.
N2O4, ΔН = –54,4кДж/моль.
Двуокись азота – бурый газ, четырехокись азота N2O4 – бесцветная жидкость. Смещение равновесия отделяется по изменению интенсивности окраски газа. U-образную трубку с двумя хорошо подобранными резиновыми пробками наполните диоксидом азота, который получите разложением нитрата свинца. Реакция протекает по уравнению:
2 Pb(NO3)2 = 2 PbO + 4 NO2 + O2.
Оба конца U-образной трубки плотно закройте резиновыми пробками, перевернув ее концами вниз, поместите одно колено трубки в стакан с горячей водой, другое – в стакан с ледяной водой.
Наблюдайте изменение окраски в том и другом колене U-образной трубки. Выньте трубку из стаканов и то колено, которое было в холодной воде, опустите в горячую воду, а колено из горячей воды – в холодную. Наблюдайте вновь изменение окраски в каждом колене. Объясните их изменения.
Опыт 3. Смещение равновесия в растворе аммиака.
В пробирку налейте по 4 мл раствора аммиака и добавьте по 2 капли фенолфталеина в каждую.
В одну из пробирок прибавьте кристаллического хлористого аммония, взболтайте и заметьте изменение цвета индикатора.
Объясните наблюдаемое явление и приведите схемы, кратко выражающие происходящие процессы.
Опыт 4. Смещение ионного равновесия при введении одноименного иона в насыщенный раствор хлористого калия.
В пробирке приготовьте насыщенный раствор хлористого калия.
Слейте осторожно с не растворившихся кристаллов раствор в другую пробирку.
К перелитому прозрачному раствору прибавьте по каплям концентрированной соляной кислоты и объясните наблюдаемое при этом явление. Изобразите протекающие реакции схемами.
Опыт 5. Определение константы равновесия гомогенной реакции.
В данном опыте определяют константу равновесия гомогенной реакции между гексаметокситрифенилкарбинолом С25Н28О7 и соляной кислотой с образованием сложного эфира и воды.
С25Н28О7 + HCl 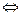 C25H27O6Cl + H2O.
C25H27O6Cl + H2O.
 2015-01-07
2015-01-07 3010
3010
