Цель работы: изучение влияния различных факторов на химическое равновесие и расчет константы равновесия.
В зависимости от природы реагирующих веществ и условий протекания химического процесса различают обратимые и необратимые реакции. Так, разложение бертолетовой соли по схеме:
KClO3 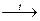 KCl +O2
KCl +O2
является реакцией необратимой, поскольку хлорид кальция не способен реагировать с кислородом. Напротив, разложение хлорида аммония при нагревании:
NH4Cl 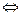 NH3 + HCl
NH3 + HCl
реакция обратимая, она не доходит до конца, так как аммиак и хлороводород в свою очередь взаимодействуют, образуя при этих условиях хлорид аммония. Таким образом, обратимыми называют реакции, протекающие в двух противоположных направлениях: необратимыми – реакции, протекающие в одном направлении до конца – до полного израсходования одного из реагирующих веществ
Химическим равновесием называют такое состояние реагирующей системы, при котором скорость прямой реакции равна скорости обратной реакции. Равенство скоростей является кинетическим условием химического равновесия.
Химическое равновесие обратимой реакции наступает тогда, когда отношение произведения концентрации образующихся веществ к произведению концентрации исходных веществ, становится равным постоянной величине, называемой константой химического равновесия. Для обратимой реакции:
H2 (г) + I2 (г) 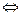 2 HI(г)
2 HI(г)
константа равновесия имеет вид:
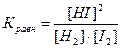
Константа равновесия зависит от природы реагентов, температуры и не зависит от исходной концентрации веществ в системе.
Химическое равновесие остается неизменным до тех пор, пока остаются постоянными параметры (C, P, t), при которых оно установилось. При изменении условий равновесие нарушается. Через некоторое время в системе вновь наступает равновесие, характеризующееся новыми равновесными концентрациями всех веществ.
Равновесие смещается в ту или иную сторону потому, что изменение условий по-разному влияет на скорость прямой и обратной реакции. Равновесие смещается в сторону той реакции, скорость которой при нарушении равновесия становится больше. Например, если при изменении внешних условий равновесие нарушается так, что скорость прямой реакции становится больше обратной реакции, то равновесие смещается вправо.
Направление, в котором смещается равновесие, определяется принципом Ле-Шателье: если на систему, находящийся в равновесии, оказать какое-либо воздействие, то равновесие смещается в том направлении, которое ослабляет эффект внешнего воздействия.
Выше сказанное относится и к водным растворам электролитов, так как электролитическая диссоциация – обратимый процесс, в котором имеет место равновесие между ионами и недиссоциированной частью вещества. Например, электролит КА в водном растворе диссоциирует:
КА 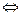 К+ + А -
К+ + А -
Сдвиг равновесия в водных растворах электролитов можно вызвать также, изменяя концентрацию частиц, находящихся в равновесии, и температуру.
 2015-01-07
2015-01-07 3115
3115
