Цель работы: изучение скорости химической реакции и ее зависимости от различных факторов: природы реагирующих веществ, концентрации, температуры.
Химические реакции протекают с различной скоростью. Скоростью химической реакции называют изменением концентрации реагирующего вещества в единицу времени. Она равно числу актов взаимодействия в единицу времени в единице объёма для реакции, протекающих в гомогенной системе (для гомогенных реакций), или на единице поверхности раздела фаз для реакций, протекающих в гетерогенной системе (для гетерогенных реакций).
Средняя скорость реакции vср . в интервале времени от t1 до t2 определяется отношением:
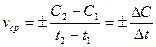 ,
,
где С1 и С2 – молярная концентрация любого участника реакции в моменты времени t1 и t2 соответственно.
Знак “–“ перед дробью относиться к концентрации исходных веществ, Δ С < 0, знак “+” – к концентрации продуктов реакции, Δ С > 0.
Основные факторы, влияющие на скорость химической реакции: природа реагирующих веществ, их концентрация, давление (если в реакции участвуют газы), температура, катализатор, площадь поверхности раздела фаз для гетерогенных реакций.
Большинство химических реакций представляют собой сложные процессы, протекающие в несколько стадий, т.е. состоящие из нескольких элементарных процессов. Элементарные или простые реакции – это реакции, протекающие в одну стадию.
Для элементарных реакций зависимость скорости реакции от концентрации выражается законом действия масс.
При постоянной температуре скорость химической реакции прямо пропорциональна произведению концентраций реагирующих веществ, взятых в степенях, равных стехиометрическим коэффициентам.
Для реакции в общем виде
а А + b В… → с С,
cогласно закону действия масс v выражается соотношением
v = К∙с(А)а ∙ с(В)b,
где с(А) и с(В) – молярные концентрации реагирующих веществ А и В;
К – константа скорости данной реакции, равная v, если с(А)а =1 и с(В)b =1, и зависящая от природы реагирующих веществ, температуры, катализатора, площади поверхности раздела фаз для гетерогенных реакций.
Выражение зависимости скорости реакции от концентрации называют кинетическим уравнением.
В случае сложных реакций закон действия масс применим к каждой отдельной стадии.
Для гетерогенных реакций в кинетическое уравнение входят только концентрации газообразных и растворенных веществ; так, для горения угля
С (к) + О2 (г) → СО2 (г)
уравнение скорости имеет вид
v = К∙с(О2)
Несколько слов о молекулярности и кинетическом порядке реакции.
Понятие «молекулярность реакции» применяют только к простым реакциям. Молекулярность реакции характеризует число частиц, участвующих в элементарном взаимодействии.
Различают моно-, би- и тримолекулярные реакции, в которых участвуют соответственно одна, две и три частицы. Вероятность одновременного столкновения трех частиц мала. Элементарный процесс взаимодействия более чем трех частиц неизвестен. Примеры элементарных реакций:
N2O5 → NO + NO + O2 (мономолекулярная)
H2 + I2 → 2HI (бимолекулярная)
2NO + Cl2 → 2NOCl (тримолекулярная)
Молекулярность простых реакций совпадает с общим кинетическим порядком реакции. Порядок реакции определяет характер зависимости скорости от концентрации.
Общий (суммарный) кинетический порядок реакции – сумма показателей степеней при концентрациях реагирующих веществ в уравнении скорости реакции, определенная экспериментально.
С повышением температуры скорость большинства химических реакций увеличивается. Зависимость скорости реакции от температуры приближено определяется правилом Вант-Гоффа.
При повышении температуры на каждые 10 градусов скорость большинства реакций увеличивается в 2–4 раза.
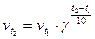 ,
,
где 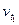 и
и 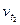 – скорость реакции соответственно при температурах t2 и t1 (t2>t1);
– скорость реакции соответственно при температурах t2 и t1 (t2>t1);
γ – температурный коэффициент скорости реакции, это число, показывающее, во сколько раз увеличивается скорость химической реакции при увеличении температуры на 100.
С помощью правила Вант-Гоффа возможно лишь примерно оценить влияние температуры на скорость реакции. Более точное описание зависимости скорости реакции температуры осуществимо в рамках теории активации Аррениуса.
Одним из методов ускорения химической реакции является катализ, который осуществляется при помощи веществ (катализаторов).
Катализаторы – это вещества, которые изменяют скорость химической реакции вследствие многократного участия в промежуточном химическом взаимодействии с реагентами реакции, но после каждого цикла промежуточного взаимодействия восстанавливают свой химический состав.
Механизм действия катализатора сводится к уменьшению величины энергии активации реакции, т.е. уменьшению разности между средней энергией активных молекул (активного комплекса) и средней энергией молекул исходных веществ. Скорость химической реакции при этом увеличивается.
 2015-01-07
2015-01-07 5129
5129
