Цель работы: проведение анализа на жесткость и умягчение воды различными методами.
Жесткость воды обусловлена содержанием в ней растворимых солей кальция и магния, гидрокарбонатов, хлоридов и сульфатов.
Различают временную (карбонатную) и постоянную (некарбонатную) жесткость воды. Временная жесткость определяется содержанием в воде растворимых гидрокарбонатов кальция и магния. При кипячении воды гидрокарбонаты переходят в малорастворимые карбонаты:
Ca(HCO3)2 = CaCO3 + CO2 + H2O,
Mg(HCO3)2 = MgCO3 + CO2 + H2O.
Таким образом, временная жесткость устраняется.
Постоянная жесткость определяется содержанием в воде кальциевых и магниевых солей сильных кислот, главным образом сульфатов и хлоридов. При кипячении эти соли не удаляются.
Сумма карбонатной и некарбонатной жесткости составляет общую жесткость воды.
Измеряют жесткость числом миллимолей эквивалентов ионов жесткости (Ca+2 и Mg+2) в 1 кг воды (ммэкв/кг). В связи с тем, что плотность воды близка к единице, жесткость можно измерять в ммэкв/дм3 или ммэкв/л.
При расчетах, связанных с жесткостью воды, следует учитывать, что Э(Ca2+) = 1/2Ca2+ и Э(Mg2+) = 1/2Mg2+, а МЭ(Ca2+) = 20 г/моль и МЭ(Mg2+) = 12 г/моль (где МЭ – молярная масса эквивалента).
Например: 0,2 г – это масса 0,01моль/экв или 10 ммоль эквивалентов Ca2+.
При контроле качества воды определяют ее жесткость. Анализ воды на жесткость предполагает обычно:
а) определение общей жесткости Жо;
б) определение карбонатной жесткости Жк;
в) вычисление некарбонатной жесткости Жнк.
Жнк = Жо – Жк.
Для определения общей жесткости используют метод комплексонометрии. В основе этого метода лежит титрование воды в присутствии аммиачно-буферного раствора (рН – 10,0) и индикатора раствора комплексона III (трилона Б) до перехода розовой окраски в голубую.
При анализе применяют один из индикаторов: кислотный хром синий К или эриохром черный Т. В присутствии ионов жесткости Ca2+ и Mg2+ эти индикаторы окрашиваются в розовый цвет, в отсутствие – в голубой.
Комплексон III – двухзамещенная натриевая соль этилендиаминтетрауксусной кислоты:




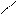
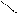 NaOOCCH2 CH2COONa
NaOOCCH2 CH2COONa
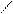 N – CH2 – CH2 – N
N – CH2 – CH2 – N


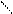 HOOCCH2 CH2COOH
HOOCCH2 CH2COOH
При титровании жесткой воды раствором комплексона III образуется внутрикомплексное соединение.
 |

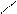 ООССН2 CH2COO 2-
ООССН2 CH2COO 2-
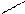

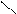
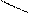

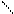 N – CH2 – CH2 – N
N – CH2 – CH2 – N


 ООССН2 Ca CH2COO
ООССН2 Ca CH2COO
Различают природную воду: очень мягкую – с жесткостью до 1,5 ммэкв/л; мягкую – от 1,5 до 4 ммэкв/л, средней жесткости – от 4 до 8 ммэкв/л, жесткую – от 8 до 12 ммэкв/л, очень жесткую – свыше 12 ммэкв/л.
При титровании жесткой воды раствором комплексон III образуется внутрикомплексное соединение (см. выше), т.е. связываются ионы Ca2+ и Mg2+. Поэтому в конце титрования индикатор изменяет окраску, раствор становится голубым.
Определение карбонатной жесткости воды Жк сводится к определению концентрации гидрокарбонат иона HCO3- и, тем самым, эквивалентной этим ионом концентрации ионов жесткости Ca2+ и Mg2+. Анализ проводят методом нейтрализации.
В основе этого метода лежит титрование воды в присутствии метилового оранжевого раствором соляной кислоты до перехода желтой окраски индикатора в оранжевую.
Анион HCO3- в воде гидрализуется
HCO3- + H2O ↔ H2CO3 + OH-
Поэтому при условии Жк > 0 вода имеет щелочную реакцию среды и метиловый оранжевый в ней окрашен в желтый цвет. При титровании раствором HCl такой воды протекает реакция нейтрализации:
Ca(HCO3)2 + 2HCl = 2СаCl2 + 2CO2 + 2H2O,
2OH- + 2H+ = 2H2O.
Ионы Н+ нейтрализуют количество ионов ОН-, эквивалентное концентрации
иона HCO3-.
 2015-01-07
2015-01-07 1551
1551
