При создании и совершенствовании химических процессов термодинамический анализ позволяет оценить:
1. вероятность протекания процесса в заданном направлении;
2. глубину превращения исходных веществ;
3. значение теплового эффекта процесса.
На основе этих оценок технолог может сделать заключение о степени использования сырья, наличии отходов (загрязнений), энергетической зависимости от внешних источников. Вероятность протекания процесса определяется знаком изменения энергии Гиббса G (это свойство вещества, характеризующее его способность вступать в реакции с другими веществами, оно зависит от температуры, давления и других параметров). Если 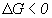 , то процесс возможен в нужном направлении, если
, то процесс возможен в нужном направлении, если 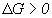 , то процесс протекает в обратную сторону, если
, то процесс протекает в обратную сторону, если 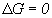 , то устанавливается состояние равновесия. Количественным показателем равновесия является константа равновесия К, определяемая как соотношение скорости прямой реакции к скорости обратной при равновесии. Для газов К выражается через парциальное давление газов Р, концентрации компонентов С и через молярные доли n. Соответственно:
, то устанавливается состояние равновесия. Количественным показателем равновесия является константа равновесия К, определяемая как соотношение скорости прямой реакции к скорости обратной при равновесии. Для газов К выражается через парциальное давление газов Р, концентрации компонентов С и через молярные доли n. Соответственно: 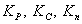 . Они связаны между собой зависимостью:
. Они связаны между собой зависимостью:
|
|
|

где: 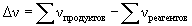 .
.
Значение 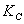 и
и 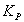 зависит от температуры,
зависит от температуры, 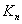 от температуры и давления. В практических расчетах чаще используют
от температуры и давления. В практических расчетах чаще используют 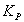 и формула в этом случае имеет вид:
и формула в этом случае имеет вид:

где: 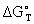 - значение энергии Гиббса для стандартных условий (в основном для
- значение энергии Гиббса для стандартных условий (в основном для 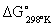 , т.е.
, т.е. 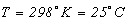 ).
).
Взаимосвязь между 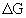 и
и 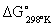 устанавливается уравнением Ван-Гоффа:
устанавливается уравнением Ван-Гоффа:

При проведении реакций, для которых 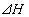 (энтальпия), постоянна в интересуемом интервале температур, используется следующая зависимость:
(энтальпия), постоянна в интересуемом интервале температур, используется следующая зависимость:

Уравнения (3) и (4) позволяют вычислить значение констант равновесия при любой температуре. Для практики следует помнить, что при 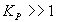 возможно практически полное превращение реагентов, при
возможно практически полное превращение реагентов, при 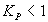 реакция протекает в обратном направлении.
реакция протекает в обратном направлении.
Через значения констант можно вычислить степень превращения 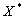 , концентрации и другие показатели. Так для простой реакции:
, концентрации и другие показатели. Так для простой реакции: 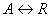 эта связь следующая:
эта связь следующая:

Количество тепла, выделяющегося (поглощающегося) в результате реакции зависит от природы реагирующих веществ, их количеств, температуры, давления и определяется на основе теплоты реакции. Если теплота реакции неизвестна, то прибегают к помощи справочных термохимических таблиц и определяют 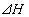 по теп лотам образования или сгорания компонентов реакции. Величина
по теп лотам образования или сгорания компонентов реакции. Величина 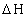 при любой температуре может быть вычислена по стандартной теплоте реакции
при любой температуре может быть вычислена по стандартной теплоте реакции 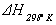 и изменении энтальпии системы в диапазоне температур от
и изменении энтальпии системы в диапазоне температур от 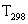 до Т:
до Т:

Если 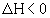 , то реакция экзотермическая, если
, то реакция экзотермическая, если 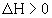 , то реакция эндотермическая. Практическое значение теплового эффекта:
, то реакция эндотермическая. Практическое значение теплового эффекта: 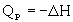
 2014-09-02
2014-09-02 927
927








