В какой массе воды надо растворить 5.85 г хлорида натрия, чтобы получить раствор, моляльность которого равна 0.3 моль 
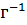 .
.
Решение. 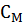 =
= 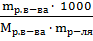 ,
,
где 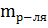 – масса растворителя в г.
– масса растворителя в г.
Отсюда 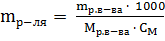 =
= 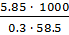 = 333.3 (г).
= 333.3 (г).
Пример 5. Вычисления, связанные с пересчетом концентраций растворов из одних единиц в другие.
Вычислите эквивалентную концентрацию, молярную концентрацию и моляльность раствора, в котором массовая доля 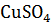 равна 0.10. Плотность раствора 1107 кг
равна 0.10. Плотность раствора 1107 кг 
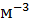 .
.
Решение. Определим молярную массу и молярную массу эквивалента 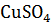 :
:
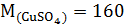 г
г 
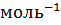 ;
; 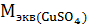 =
= 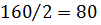 г
г 
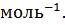
В 100 г раствора с 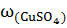 = 0.1 содержится 10.0 г
= 0.1 содержится 10.0 г 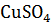 и 90 г
и 90 г 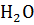 .
.
Следовательно, 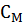 раствора
раствора 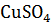 равна:
равна:
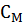 =
= 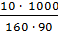 = 0.7 моль
= 0.7 моль 
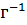 .
.
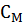 и
и 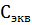 относятся к 1 л раствора:
относятся к 1 л раствора:
M = 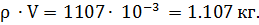
В этой массе раствора содержится 1.107 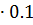 = 0.1107 кг
= 0.1107 кг 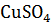 , что составляет 110.7/159.61 = 0.693 моль, или 0.693
, что составляет 110.7/159.61 = 0.693 моль, или 0.693 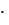 2 = 1.386 экв.
2 = 1.386 экв.
Молярная концентрация и эквивалентная концентрация данного раствора соответственно равны 0.693 и 1.386 моль 
 .
.
Пример 6. Расчеты, связанные с приготовлением разбавленных растворов из концентрированных.
Какой объем раствора азотной кислоты с массовой долей 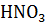 0.3 (
0.3 (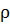 = 1180 кг
= 1180 кг 
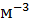 ) требуется для приготовления 20 л 0.5 М раствора этой кислоты?
) требуется для приготовления 20 л 0.5 М раствора этой кислоты?
Решение. Сначала определяем массу азотной кислоты в 20 л 0.5 раствора:
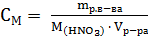 ;
; 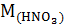 = 63 г
= 63 г 
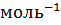 ;
; 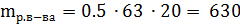 г.
г.
Так как 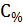 =
= 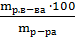 =
= 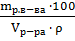 (%);
(%);
Следовательно, для приготовления 20 л 0.5 М раствора 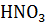 надо израсходовать всего 1.78 л раствора азотной кислоты 30%-ой концентрации.
надо израсходовать всего 1.78 л раствора азотной кислоты 30%-ой концентрации.
 2015-01-13
2015-01-13 1964
1964








