Осмотическое давление прямо пропорционально молярной концентрации раствора (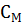 ) и абсолютной температуре (Т). Эта зависимость дается уравнением Ванг-Гоффа:
) и абсолютной температуре (Т). Эта зависимость дается уравнением Ванг-Гоффа:
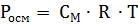 ,
,
где R - универсальная газовая постоянная, значение которой определяется принятыми единицами измерения. Если давление измерять в Па, а объем в 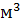 , то R = 8.3144 Дж
, то R = 8.3144 Дж 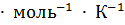 , Т - абсолютная температура.
, Т - абсолютная температура.
Поскольку 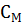 = n/V,то уравнение Вант - Гоффа аналогично уравнению Менделеева - Клапейрона, которое характеризует газовое состояние вещества:
= n/V,то уравнение Вант - Гоффа аналогично уравнению Менделеева - Клапейрона, которое характеризует газовое состояние вещества:
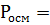
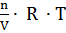 =
= 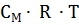 ,
,
где n - число молей растворенного вещества;
V - объем раствора.
Заменяя 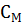 в выражении Р =
в выражении Р = 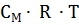 его выражением по формуле для молярной концентрации:
его выражением по формуле для молярной концентрации:
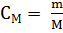 ,
,
где m - масса растворенного вещества;
М - молярная масса растворенного вещества;
получим формулу, удобную для вычисления молярной массы растворенного вещества.
Пример 1. Вычисление осмотического давления растворов.
Определить величину осмотического давления раствора, если в 500 мл раствора содержится 1.8 г глюкозы 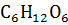 при-25 °С.
при-25 °С.
Решение. Осмотическое давление раствора определяют согласно закону Вант - Гоффа:
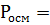
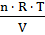 .
.
В 0.5 л раствора содержится 1.8 г глюкозы, молярная масса которой равна 180 г 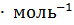 . Следовательно, в 0.5 л раствора содержится n= 1.8: 180 = 0.01 моль глюкозы.
. Следовательно, в 0.5 л раствора содержится n= 1.8: 180 = 0.01 моль глюкозы.
Осмотическое давление этого раствора глюкозы:
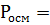
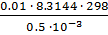 = 0.49
= 0.49 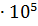 Па.
Па.
Пример 2. Вычисление молярной массы неэлектролита по относительному понижению давления пара растворителя над раствором.
Навеска вещества массой 12.42 г растворена в воде объемом 500 мл. Давление пара полученного раствора при 20 °С равно 3732.7 Па. Давление пара воды при той же температуре 3742 Па. Как по этим данным найти молярную массу (М) растворенного вещества?
Решение. Для определения М надо вычислить n, пользуясь законом Рауля:
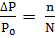 , откуда n =
, откуда n = 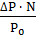 ,
,
так как 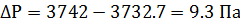 и N =
и N = 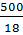 = 27.78 моль, то
= 27.78 моль, то
n = 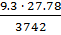 = 0.069 моль.
= 0.069 моль.
Поскольку n = 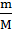 , то M =
, то M =  =
= 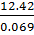 = 180 г
= 180 г 
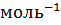 .
.
 2015-01-13
2015-01-13 7398
7398
