Давление пара растворов ниже давления пара чистых растворителей при той же температуре. Понижение давления пара 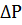 , отнесенное к
, отнесенное к 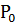 (
(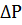 /
/ 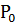 ) называют относительным понижением давления насыщенного пара раствора.
) называют относительным понижением давления насыщенного пара раствора.
Закон Рауля: относительное понижение давления насыщенного пара растворителя над раствором равно молярной доле растворенного вещества,
т.е, 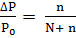 ,
,
где N и n - количества растворителя и растворенного вещества соответственно.
Закон Рауля используют для определения молярной массы вещества.
Пример 1. Вычисление давления пара растворителя над раствором. Определите давление пара растворителя над раствором, содержащим 1.212•1023 молекул неэлектролита в 100 г воды при 100 °С. Давление пара воды при 100°С равно 1.0133 • 103 Па.
Решение. Относительное понижение давления пара растворителя над раствором согласно закону Рауля выражается соотношением 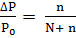 . Количество растворителя N и растворенного вещества n находим:
. Количество растворителя N и растворенного вещества n находим:
N = 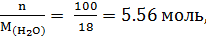 n =
n = 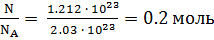 .
.
Давление пара над раствором:
Р = 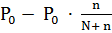 = 1.0133
= 1.0133 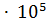 -.0133
-.0133 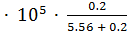 = 0.98
= 0.98 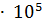 Па.
Па.
Пример 2. Вычисление молярной массы неэлектролита по относительному понижению давления пара растворителя над раствором.
Рассчитайте молярную массу неэлектролита, если 28.5 г этого вещества, растворенного в 785 г воды, вызывают понижение давления пара воды над раствором на 52.37 Па при 40 °С. Давление водяного пара при этой же температуре равно 7375.9 Па.
Решение. Относительное понижение давления пара растворителя над раствором равно 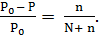
Находим: N = 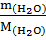 =
= 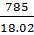 = 43.56 моль; n =
= 43.56 моль; n = 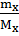 =
= 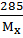 ,
,
здесь 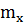 - неэлектролита, молярная масса которого
- неэлектролита, молярная масса которого 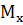 г
г 
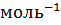 .
.
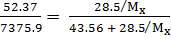 ; 0.309
; 0.309 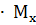 + 0.202 = 28.5.
+ 0.202 = 28.5.
0.309 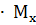 = 28.298;
= 28.298; 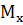 = 91.58 г
= 91.58 г 
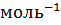 .
.
Молярная масса неэлектролита равна 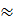 92 г
92 г 
 .
.
 2015-01-13
2015-01-13 5309
5309
